题目内容
14.几种短周期元素的原子半径及主要化合价见下表:下列叙述不正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、M的单质在相同条件下与相同浓度稀盐酸反应的反应速率为L>M | |
| B. | M与T形成的化合物有两性 | |
| C. | Q是硫元素 | |
| D. | L、Q形成的简单离子核外电子数相等 |
分析 L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg;Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据M原子半径大于Q小于L可知应和L同周期,为Al元素,结合元素周期律知识解答该题.
解答 解:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg;Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据M原子半径大于Q小于L可知应和L同周期,为Al元素.
A.金属性Mg>Al,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>M,故A正确;
B.Al与O形成氧化铝具有两性,故B正确;
C.Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,故C正确;
D.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故D错误.
故选:D.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
5.下列晶体熔化时不需破坏化学键的是( )
| A. | 晶体硅 | B. | 二氧化硅晶体 | C. | 干冰 | D. | 金属钾 |
9.可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
| A. | 酸性高锰酸钾溶液、溴水 | B. | 酸性高锰酸钾溶液、碳酸钠溶液 | ||
| C. | 酸性高锰酸钾溶液、氢氧化钠溶液 | D. | 酸性高锰酸钾溶液、氯化钠溶液 |
19.氧化还原反应在生产、生活中应用广泛.下列反应不属于氧化还原反应的是( )
| A. | 木炭燃烧:C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 | |
| B. | 煅烧石灰石:CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑ | |
| C. | 铁的冶炼:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| D. | 电解水:2H2O$\frac{\underline{\;通电\;}}{\;}$2 H2↑+O2↑ |
6.下列叙述错误的是( )
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到平衡状态时,正、逆反应速率相等 | |
| C. | 化学反应达到平衡状态与时间的长短无关 | |
| D. | 化学平衡状态是不可改变的 |
3.下列关于有机物说法正确的是( )
| A. | 乙醇、乙醛和乙酸都可以与钠反应生成氢气 | |
| B. | 95%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 乙炔和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 福尔马林除了可用于保存生物标本,也可用于食品的保鲜 |
4.下列叙述中正确的是( )
| A. | 漂白粉中的有效成分为次氯酸钙,在空气中可以长时间放置而不变质 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 美国纽约冬季城市供暖使用的主要能源是天然气,天然气属于不可再生能源 | |
| D. | 虎门销烟中用到了大量的生石灰,将生石灰投入销烟池的海水中,海水开始翻腾,这是一个物理变化 |
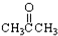 ③CH3CH2Br ④
③CH3CH2Br ④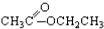 ⑤
⑤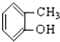 ⑥
⑥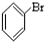 ⑦
⑦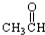 ⑧
⑧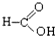 ⑨
⑨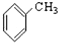 ⑩
⑩