题目内容
11.下列关于如图所示装置的说法中,正确的是( )
| A. | 铜片是该装置的负极 | |
| B. | 负极反应为Zn-2e-═Zn2+ | |
| C. | 该装置能将电能转化为化学能 | |
| D. | 装置中电流计指针发生偏转,电子由铜片通过导线流向锌 |
分析 Zn+H2SO4=ZnSO4+H2↑设计成原电池,根据化合价变化知,负极是锌,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应生成氢气,电子从负极沿导线向正极,由此分析.
解答 解:A.活泼金属锌作负极,铜作正极,故A错误;
B.锌作负极失电子发生氧化反应,电极反应为:Zn-2e-═Zn2+,故B正确;
C.该装置能将化学能转化为电能,故C错误;
D.装置中电子由负极锌片流出,通过导线流向正极铜,产生电流,电流计指针发生偏转,故D错误;
故选B.
点评 本题考查原电池原理,明确工作原理是解本题的关键,再结合电池反应式来分析解答即可,难度不大.

练习册系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | 氨水吸收足量的SO2气体:OH-+SO2═HSO3- | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-═NO2-+H2O | |
| D. | 往AlCl3溶液中滴加过量的NaOH溶液:Al3++4OH-═AlO2-+2H2O |
19.下列各组离子可以在溶液中大量共存的是( )
| A. | Mg2+、K+、SO42-、OH- | B. | Na+、Ag+、NO3-、Cl- | ||
| C. | H+、Ba2+、NO3-、Cl- | D. | Ca2+、K+、CO32-、NO3- |
6.下列物质既含有共价键又含有离子键的是( )
| A. | NaCl | B. | Cl2 | C. | HCl | D. | NaOH |
16.利用如图实验装置进行的相应实验,不能达到实验目的是( )
| A. | 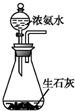 可制取氨气 | |
| B. | 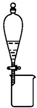 可分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. | 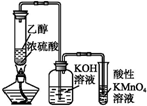 可制取乙烯并验证其易被氧化 | |
| D. | 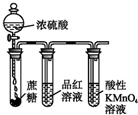 可说明浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性 |
3.化学与生活、社会、科学、技术、环境等息息相关.下列有关说法不正确的是( )
| A. | 12C和14C互为同位素,其中14C可用于文物的年代的鉴定 | |
| B. | 在元素周期表的金属和非金属分界线附近适合寻找半导体材料 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,药学家屠呦呦对青蒿素的提取属于物理变化 | |
| D. | 煤、石油、天然气属于重要的可再生能源,而氢氧燃料电池则是一种能量转换率较高、符合绿色化学理念的新型动力电源 |
20.下列说法不正确的是( )
| A. | CH3CO18OH与CH3OH发生酯化反应达到平衡后,18O仅存在于乙酸、水分子里 | |
| B. | 在体积可变的密闭容器中在一定条件下2molSO2和2molO2发生反应:2SO2(g)+O2═2SO3(g),达到反应最大限度时,容器体积变为反应前的81.25%,则SO2转化率为70% | |
| C. | 对于任何化学反应来说,反应速率越快,反应现象不一定就越明显 | |
| D. | 某同学在用锌片与稀硫酸反应制取氢气时,向反应器中加入少量CuSO4固体(不考虑温度变化),则此时产生H2的化学反应速率加快 |
 的单体为
的单体为 ,反应类型为加成聚合反应.
,反应类型为加成聚合反应.