题目内容
下列各组物质中,常温下能起反应并产生氢气的是( )
| A、炭与浓硝酸 |
| B、铝与稀硫酸 |
| C、铁与浓硝酸 |
| D、铜与浓硫酸 |
考点:硝酸的化学性质,浓硫酸的性质
专题:元素及其化合物
分析:根据金属和酸的性质及反应条件判断.
解答:
解:A.常温下,炭和浓硝酸不反应,故A错误;
B.常温下,铝与稀硫酸反应生成硫酸铝和氢气,故B正确;
C.常温下,浓硝酸能使铁发生钝化,在铁的表面生成致密的氧化膜,阻止铁和浓硝酸进一步的反应,故C错误;
D.常温下,铜和浓硫酸不反应,故D错误,
故选B.
B.常温下,铝与稀硫酸反应生成硫酸铝和氢气,故B正确;
C.常温下,浓硝酸能使铁发生钝化,在铁的表面生成致密的氧化膜,阻止铁和浓硝酸进一步的反应,故C错误;
D.常温下,铜和浓硫酸不反应,故D错误,
故选B.
点评:本题考查了常见金属的化学性质,难度不大,注意在常温下,炭和浓硝酸不反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应的能量变化属于吸热反应的是( )
| A、氯化铵与Ba(OH)2?8H2O的反应 |
| B、氢氧化钠溶液与盐酸反应 |
| C、锌片与稀硫酸反应 |
| D、钠与冷水反应 |
工业上用H2和N2直接合成氨:N2+3H2═2NH3,下列措施肯定能使合成氨反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④增大压强.
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④增大压强.
| A、只有①②③ | B、只有①②④ |
| C、只有①③④ | D、①②③④ |
下列实验能获得成功的是( )
| A、在溴化铁的催化下苯与浓溴水反应制取溴苯 |
| B、制硝基苯时,在浓硫酸中加入浓硝酸后,立即加苯混合,进行振荡 |
| C、加热3mol/L的硫酸与乙醇的混合液至170℃,制取乙烯 |
| D、溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去 |
如图,学生甲已将四种物质按照一定分类标准分类归入到椭圆形中,下列说法正确的是( )
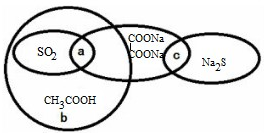

| A、SO2的水溶液能导电,所以SO2是电解质 |
| B、b可以代表含氧元素的离子化合物 |
| C、SO2、Na2C2O4均可作还原剂使酸性KMnO4溶液褪色 |
| D、CH3COOH与Na2S的反应称为酸碱中和反应 |
乙醇分子中不同的化学键如图所示,对乙醇在各种反 应中应断裂的键说明不正确的是( )


| A、和钠作用键①断 |
| B、和浓H2SO4作用到170℃,键②和键⑤断 |
| C、和乙酸、浓H2SO4共热,键②断 |
| D、在Cu作用和O2反应,键①和键③断 |
下列实验装置设计正确的是( )
A、 干燥氢气 |
B、 稀释浓硫酸 |
C、 可移动铜丝符合绿色化学要求 |
D、 氨尾气吸收 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、室温下,42g乙烯和丙烯的混合气体中含有的碳原子数约为3NA |
| B、1mol C10H22分子中共价键总数为30NA |
| C、标准状况下,22.4 L四氯化碳的分子数为NA? |
| D、15g CH3+(碳正离子)中含有电子数为10NA |