题目内容
12.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂如图1,答下列问題: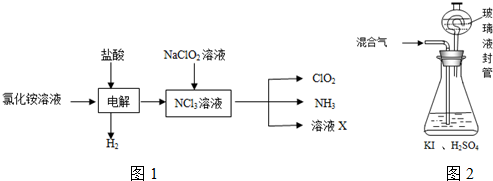
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1.
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:电解时发生反应的化学方程式2为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$ NCl3+3H2↑.
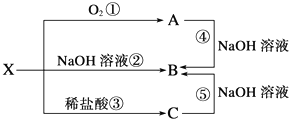
②溶液X中大量存在的阴离子有Cl-、OH-.
③除去ClO2中的NH3可选用的试剂是c(填标号).
a.水 b.碱石灰 c.浓硫酸d.饱和食盐水
(3)用如图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol•L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O.
②玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出).
③V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内溶液颜色不再改变.
④测得混合气中ClO2的质量为0.02700g..
(4)O2处理过的饮用水含亚氯酸盐.要除去超标亚氯酸盐,下列最适宜的是d填标号.
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁.
分析 (1)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②玻璃液封装置可防止有害气体逸出;
③淀粉遇碘单质变蓝;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
(4)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子.
解答 解:(1)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,
故答案为:2:1;
(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,发生NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液X中大量存在的阴离子有Cl-、OH-,
故答案为:Cl-、OH-.
③a.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故错误;
b.碱石灰不能吸收氨气,故错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故正确;
d.ClO2易溶于水,不能利用水吸收氨,故错误;
故答案为:c;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出),故答案为:吸收残留的ClO2气体(避免碘的逸出).
③V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,
故答案为:淀粉溶液,溶液由蓝色变为无色,且半分钟内溶液颜色不再改变.
④含有Na2S2O3物质的量为0.02 L×0.1mol/L=0.002 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,
所以m(ClO2)=0.0004 mol×67.5g/mol=0.02700g,
故答案为:0.02700;
(4)若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,
故答案为:d.
点评 本题考查物质含量的测定,为高频考点,为2015年高考真题,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.

 甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )
甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )| A. | 乙的单质在空气中燃烧生成的化合物只含离子键 | |
| B. | 丙可作半导体材料 | |
| C. | 丁与已核外电子数相差12 | |
| D. | 戊和己都不是主族元素,而是过渡元素 |
| A. | “加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质 | |
| B. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 | |
| C. | 医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 | |
| D. | “酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 |