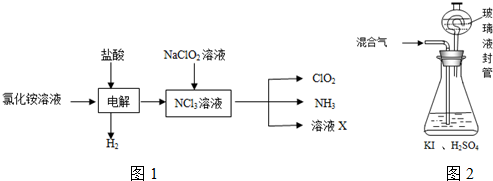
题目内容
7.某固定容积的2L密闭容器中进行 N2+3H2?2NH3,起始加入的N2、H2、NH3均为2mol,5min后H2的物质的量为0.5mol,求:(1)这5min内用N2来表示该反应的反应速率(请写出计算过程,下同)
(2)求5min后NH3的物质的量浓度;
(3)5min后容器中气体的总物质的量相比起始的气体的总物质的量变化了多少?
分析 某固定容积的2L密闭容器中,起始加入的N2、H2、NH3均为2mol,5min后H2的物质的量为0.5mol,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):2 2 2
变化(mol):0.5 1.5 1
5min后(mol):1.5 0.5 3
根据v=$\frac{△c}{△t}$计算v(N2),根据c=$\frac{n}{V}$计算5min后NH3的物质的量浓度.
解答 解:某固定容积的2L密闭容器中,起始加入的N2、H2、NH3均为2mol,5min后H2的物质的量为0.5mol,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):2 2 2
变化(mol):0.5 1.5 1
5min后(mol):1.5 0.5 3
(1)5min内用N2来表示该反应的反应速率v(N2)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L.min),
答:5min内用N2来表示该反应的反应速为0.05mol/(L.min);
(2)5min后NH3的物质的量浓度为$\frac{3mol}{2L}$=1.5mol/L,
答:5min后NH3的物质的量浓度为1.5mol/L;
(3)气体的物质的量减少:(2+2+2)mol-(1.5+0.5+3)mol=1mol,
答:气体的物质的量减少1mol.
点评 本题考查化学平衡计算、反应速率计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
9.下列有关焰色反应叙述正确的是( )
| A. | 可用洁净的铁丝代替铂丝进行焰色反应 | |
| B. | 焰色反应是金属单质的特性 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 氯化钠在火焰上灼烧时火焰呈紫色 |
15. 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
下列说法不正确的是( )
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.下列说法不正确的是( )
| A. | 反应开始时,B容器中化学反应速率比A容器中快 | |
| B. | A容器中X的转化率为20%,且比B容器中X的转化率小 | |
| C. | 打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计) | |
| D. | 打开K达新平衡时,升高B容器的温度,A容器的体积会增大 |
2. CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
①t min内CO2的平均反应速率为$\frac{1}{t}$mol•L-1•min-1.此温度下该反应的平衡常数K=64
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
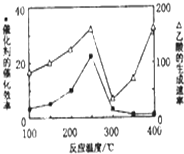
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
16.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | 标准状况下,1molH2O的体积约为22.4L | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
17.如图所示,实验操作能达到相应的实验目的是( )
| A. |  称量氢氧化钠固体的质量 称量氢氧化钠固体的质量 | |
| B. |  分离沸点相差较大的互溶液体混合物 分离沸点相差较大的互溶液体混合物 | |
| C. |  用排气法收集氯气 用排气法收集氯气 | |
| D. |  分离互不相溶的两种液体 分离互不相溶的两种液体 |