题目内容
15.常温下,下列三种溶液中,由水电离出的氢离子浓度之比为( )①1mol/L的盐酸②0.1mol/L的盐酸③0.01mol/L的NaOH.
| A. | 1:10:100 | B. | 0:1:12 | C. | 14:13:12 | D. | 14:13:2 |
分析 根据溶液中Kw=c(H+)•c(OH-)来计算即可.
解答 解:①1mol/L的盐酸中由水电离出的氢离子浓度$\frac{1{0}^{-14}}{1}$mol/L=10-14mol/L,
②0.1mol/L的盐酸中由水电离出的氢离子浓度$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,
③0.01mol/L的NaOH中由水电离出的氢离子浓度$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,
由水电离出的氢离子浓度之比为10-14mol/L:10-13mol/L:10-12mol/L=1:10:100,故选A.
点评 本题考查学生水的离子及常数的计算知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
5.下列物质中属于非电解质的是( )
| A. | 铁 | B. | 酒精 | C. | NaCl溶液 | D. | 氯化氢 |
6.在标准状况下,将1molH2和11.2LO2混合,得到气体的体积为( )
| A. | 12.2 L | B. | <22.4 L | C. | 33.6 L | D. | 无法确定 |
10.分类是重要的科学研究方法,下列物质归类正确的是( )
| A. | 碱:苛性碱、纯碱、火碱 | |
| B. | 碱性氧化物:氧化铜、氧化铁、七氧化二锰、二氧化硅 | |
| C. | 混合物:水煤气、矿泉水、盐酸 | |
| D. | 无丁达尔现象的分散系:氯化铁溶液、碘的四氯化碳溶液、蒸馏水 |
20.下列说法正确的是( )
| 元素 | 有关信息 |
| X | 所在主族序数与所在周期序数之差为4,在该周期中原子半径最小 |
| Y | 在最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W | 地壳中含量最高的金属元素 |
| A. | W与Y的最高价氧化物对应的水化物之间可相互反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rW | |
| C. | 向浓ZX3溶液中滴加少量的Na2SO3溶液,可产生大量沉淀和气体 | |
| D. | 可用电解W与X形成的化合物来制取W单质 |
7.X,Y,Z,W为原子序数依次增大的四种短周期元素,它们分别处在两个周期,Y和W同主族,化合物ZW2的水溶液显酸性,X和Z可疑构成离子化合物ZX,下列说法错误的是( )
| A. | 离子半径:X2->Y->Z2+ | |
| B. | 单质的熔点:Z>W>Y | |
| C. | 能破坏水的电离平衡的离子为:Y-,Z2+,W- | |
| D. | 离子化合物ZX的熔点高,ZX可作为耐火材料 |
18.在下列反应中,水作氧化剂的是( )
| A. | 2K+2H2O═2KOH+H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2H2O2═2H2O+O2↑ |
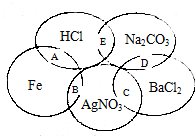 如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题: