题目内容
6.在标准状况下,将1molH2和11.2LO2混合,得到气体的体积为( )| A. | 12.2 L | B. | <22.4 L | C. | 33.6 L | D. | 无法确定 |
分析 根据V=nVm计算氢气的体积,氢气与氧气体积之和即为总体积.
解答 解:标况下气体摩尔体积为22.4L/mol,则1mol氢气体积为1mol×22.4L/mol=22.4L,故在标准状况下,将1molH2和11.2LO2混合,得到气体的体积为22.4L+11.2L=33.6L,
故选:C.
点评 本题考查气体摩尔体积的有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
16.氯气是一种化学性质很活泼的非金属单质,其具有较强的氧化性.下列叙述中不正确的是( )
| A. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| B. | 钠在氯气中燃烧,生成白色的烟 | |
| C. | 氯气能与水反应生成次氯酸和盐酸,久置的氯水最终变为稀盐酸 | |
| D. | 实验室制取氯气时,为了防止污染环境,多余的氯气可用澄清石灰水吸收 |
14.被称为万能还原剂的NaBH4溶于水并和水发生如下反应:NaBH4+H2O-→H2↑+NaBO2(未配平,其中NaBH4中H元素为-1价),则下列说法正确的是( )
| A. | 被氧化元素与被还原元素的质量比为1:1 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | NaBH4既是氧化剂,又是还原剂 |
1.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,1.6gCH4含有的电子数目为NA | |
| B. | 标准状况下,2.2 LCCl4含有的碳原子数目为0.1NA | |
| C. | 101kPa、0℃时,22.4LH2中氢原子数为NA个 | |
| D. | 1mol/L 的NaOH溶液中,Na+的数目为NA |
11.一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法不正确的是( )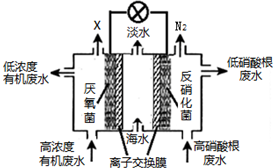

| A. | 中间室Cl-移向左室 | |
| B. | X气体为CO2 | |
| C. | 处理后的含硝酸根废水pH降低 | |
| D. | 电路中每通过4 mol电子,产生标准状况下X的体积为22.4L |
18.下列说法不正确的是( )
| A. | 任何化学反应都伴随着能量变化 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 化学反应会引起化学键的变化 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
15.常温下,下列三种溶液中,由水电离出的氢离子浓度之比为( )
①1mol/L的盐酸②0.1mol/L的盐酸③0.01mol/L的NaOH.
①1mol/L的盐酸②0.1mol/L的盐酸③0.01mol/L的NaOH.
| A. | 1:10:100 | B. | 0:1:12 | C. | 14:13:12 | D. | 14:13:2 |
9.Ⅰ.实验室为测定一新配制的稀盐酸的准确浓度,通常是用纯净的Na2CO3(无水)配成标准溶液滴定.具体操作是:称取wg纯净的无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定.(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4~5之间,那么指示剂宜选,当滴定至溶液由黄 色变成橙色时,即表示到达终点;
Ⅱ.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液.
(2)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手,两眼注视,直到滴定终点.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:.
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度.
Ⅱ.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液.
(2)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中.(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手,两眼注视,直到滴定终点.
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:.
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |