题目内容
7.如图1是某同学在实验室中进行铝热反应的实验装置,实验中他观察到的现象之一为:“纸漏斗的下部被烧穿,有熔融物落入沙中”,该反应的化学方程式是Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,其能量变化可用图2中的a(填“a”或“b”)表示.在反应中用到了镁条和氯酸钾,氯酸钾的作用是分解产生氧气,使镁条充分燃烧放出大量热.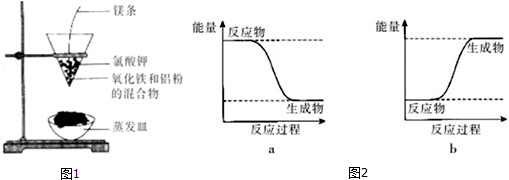
分析 加热条件下,铝和氧化铁反应生成氧化铝和铁,为置换反应,反应中生成熔融物,说明金属熔化,应为放热反应,以此解答该题.
解答 解:反应剧烈,漏斗下方有红热熔融物流出,说明该反应为放热反应,方程式为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2 Fe,反应物总能量大于生成物总能量,所以可用图2中的a表示;
故答案为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2 Fe; a;分解产生氧气,使镁条充分燃烧放出大量热.
点评 本题考查化学反应的热量变化,为高频考点,侧重于学生的分析能力和实验能力的考查,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
相关题目
11.下列反应的离子方程式,书写错误的是( )
| A. | 氢氧化铁与盐酸反应OH-+H+═H2O | |
| B. | 用稀硫酸清除铁锈Fe2O3+6H+═2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液Cl-+Ag+═AgCl↓ | |
| D. | 氢氧化钡跟硫酸铜溶液的反应Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
5.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:

已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化成MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为
5Mn2++2ClO${\;}_{3}^{-}$+□4H2O═□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生,其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

已知:
生成氢氧化物沉淀的pH
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化成MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为
5Mn2++2ClO${\;}_{3}^{-}$+□4H2O═□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生,其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).