题目内容
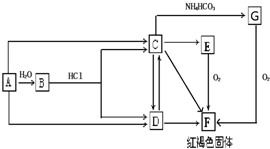
5. 神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:
神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:(1)管道①的作用是将飞船座舱中含CO2的空气通入“电化学CO2处理系统”的N极室,通过该电极反应可以使CO2不断被吸收,则N极为正极(填“正”或“负”),其电极反应为:2H2O+O2+4e-=4OH-,其电极产物吸收CO2后形成的阴离子会通过隔膜进入M极室,与M极上产生的产物反应又生成CO2.从电解质溶液中释放出来,并保持系统内pH不变.M电极反应式为H2+2e-=2H+.
(2)管道②的作用是将处理后的空气混入“电解水系统产生的新鲜氧气”,然后通入飞船座舱内供宇航员呼吸.在电解水系统中,Y为阴极(填“阴”或“阳”),X极的电极反应式4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑).
分析 (1)含CO2的空气通入“电化学CO2处理系统”的N极室,N极上氧气得电子为正极,M极上氢起失去电子,氢离子与碳酸根离子反应生成二氧化碳和水;
(2)由图可知,Y极上氢离子得到电子生成氢气,为阴极,X极上氢氧根离子失去电子生成氧气.
解答 解:(1)含CO2的空气通入“电化学CO2处理系统”的N极室,N极上氧气得电子为正极,电极反应为2H2O+O2+4e-=4OH-,吸收CO2的离子方程式为2OH-+CO2=CO32-+H2O,M极上氢起失去电子,该电极反应为H2+2e-=2H+,氢离子与碳酸根离子反应生成二氧化碳和水,所以CO2逸出的离子方程式为2H++CO32-=CO2+H2O,
故答案为:正;2H2O+O2+4e-=4OH-;H2+2e-=2H+;
(2)由图可知,Y极上氢离子得到电子生成氢气,为阴极,而X极上氢氧根离子失去电子生成氧气,电极反应为4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑),
故答案为:阴;4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑).
点评 本题以信息形式考查原电池和热化学反应方程式,注意信息与所学知识的结构,明确图中生成物及得失电子是分析电极反应的关键,题目难度中等.

练习册系列答案
相关题目
13.下列叙述错误的是( )
| A. | 金属钠在自然界中能以游离态存在 | |
| B. | 金属钠着火时,用细沙覆盖灭火 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 钠在空气中燃烧生成过氧化钠 |
20.下列关于CO2和SO2气体的说法不正确的是( )
| A. | 与足量的澄清石灰水反应的现象不同 | |
| B. | 通入BaCl 2溶液时现象相同 | |
| C. | 通入Ba(NO3)₂溶液时现象相同 | |
| D. | 通入石蕊溶液时现象相同 |
17. 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )| A. | 作用时电子由Zn极经外电路流向Ag2O极,Zn是负极 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极 | |
| C. | 正极的电极反应为Ag2O+2e-+H2O═2Ag+2OH- | |
| D. | Zn极发生氧化反应,Ag2O极发生还原反应 |
14.下列有关电化学装置完全正确的是( )
| A. |  铁片镀锌 | B. |  模拟吸氧腐蚀 | C. |  铜锌原电池 | D. |  电解法制氯气 |
15.ClO2是一种安全、高效、强力杀菌剂,其性质如表:
回答下列问题:
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)