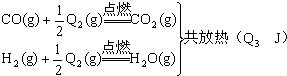题目内容
8.已知1.505×1023个X气体分子的质量为16g,请计算X气体的摩尔质量.( 书写计算过程,注意规范书写 )分析 先根据n=$\frac{N}{{N}_{A}}$计算出1.505×1023个X气体分子的物质的量,然后根据M=$\frac{m}{n}$计算出X气体的摩尔质量.
解答 解:1.505×1023个X气体分子的物质的量为:$\frac{1.505×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.25mol
则X气体的摩尔质量为:M(X )=$\frac{16g}{0.25mol}$=64 g/mol,
答:X气体的摩尔质量为64g/mol.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
16.下列说法正确的是( )
| A. | 在常温、常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA | |
| C. | 在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L | |
| D. | 标准状况下,1 mol CCl4的体积是22.4 L |
13.下列有关实验操作的叙述,正确的是( )
| A. | 用100毫升量筒量取8.5毫升水 | |
| B. | 在台式天平的左右盘中各放一纸片,调平后,左盘放药品,右盘放砝码并调整游码,称取一定质量的氢氧化钠固体 | |
| C. | 加热试管前,用抹布将试管外壁擦干,以防试管受热不匀而破裂 | |
| D. | 在看到氢气发生器中稀硫酸与锌粒反应开始产生较多气泡时,即可在气体导出管口点燃氢气 |
17.已知反应A(g)+3B(g)?2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2mol/(L•s),则以C的浓度变化表示的反应速率为( )
| A. | 1 mol/(L•s) | B. | 3 mol/(L•s) | C. | 4 mol/(L•s) | D. | 2 mol/(L•s) |