题目内容
6.盐酸、硫酸和硝酸是中学阶段常见的三种酸.试回答下列问题:(1)浓盐酸、浓硫酸长期露置在空气中,溶液浓度分别减小.(填“减小”、“增大”或“不变”)
(2)将铝片投入酸X中,铝片未见溶解,将酸X稀释后铝片溶解并产生无色气体,由此推断酸X是B(填字母),铝片未见溶解的原因是钝化.
A.浓盐酸B.浓硫酸C.浓硝酸
(3)向一定体积的18.4mol.L-1浓硫酸中加入过量铜片,加热使之反应,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑反应完全后,加入下列试剂,铜片会继续溶解的是CD(填字母序号)
A.稀盐酸B.稀硫酸C.稀硝酸D.硝酸钾.
分析 (1)浓盐酸易挥发,浓硫酸具有吸水性;
(2)将铝片投入酸X中,铝片未见溶解,将酸X稀释后铝片溶解并产生无色气体,则开始发生钝化,后生成无色气体为氢气,而浓、稀硝酸均具有强氧化性;
(3)Cu与浓硫酸反应生成硫酸铜和二氧化硫、水,Cu与稀硫酸不反应,则加具有氧化性的物质或硝酸盐可使铜片会继续溶解.
解答 解:(1)浓盐酸易挥发,浓硫酸具有吸水性,前者溶质减少,后者溶剂增多,则长期露置在空气中,溶液浓度均减小,故答案为:减小;
(2)将铝片投入酸X中,铝片未见溶解,将酸X稀释后铝片溶解并产生无色气体,由此推断酸X是B,铝片未见溶解的原因是钝化,故答案为:B 钝化;
(3)向一定体积的18.4mol.L-1浓硫酸中加入过量铜片,加热使之反应,反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,反应完全后,加入C或D铜片会继续溶解,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;CD.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
16.向纯水中加入少量H2SO4,当温度不变时,该溶液中增大的量是( )
| A. | c(OH-) | B. | c(H+) | ||
| C. | c(OH-) 与 c(H+) 的乘积 | D. | 水电离出的 c(H+) |
14.下列反应中,属于取代反应的是( )
| A. | 乙烯在空气中燃烧 | B. | 苯在一定条件下跟H2反应 | ||
| C. | 苯在浓硫酸催化下与浓硝酸反应 | D. | 乙烯在一定条件下跟HCl反应 |
1.我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅.下列物品中用到硅单质的是( )
| A. | 陶瓷餐具 | B. | 石英钟表 | C. | 计算机芯片 | D. | 光导纤维 |
11.对于反应N2+O2?2NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
| A. | 缩小体积使压强增大 | B. | 降低温度 | ||
| C. | 体积不变充入H2使压强增大 | D. | 压强不变充入稀有气体氖 |
18.某化合物有碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
| A. | CH3CH2OCH3 | B. | CH3CH(OH)CH3 | C. | CH3CH2COOH | D. | CH3CH2CHO |
15.下列过程中所发生的化学变化属于取代反应的是( )
| A. | 乙酸和乙醇的酯化反应 | |
| B. | 乙醇与Na反应 | |
| C. | 乙醇与氧气在Cu作催化剂条件下反应 | |
| D. | 在镍作催化剂的条件下,苯与氢气反应 |
8.①②③④⑤⑥⑦⑧八种元素,在元素周期表中的位置如图所示,回答下列问题:
(1)①②③④⑤⑥⑦⑧八种元素中,金属性最强的元素其最高价氧化物对应水化物的溶液与Al反应化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑;
(2)元素①和⑧可以形成的化合物,其中原子个数比为1:1的化合物的结构式为H-O-O-H化学键类型为极性键非极性键
元素②和⑧可以形成的化合物,其中原子个数比为1:1的化合物的电子式为
(3)用电子式表示⑤和②原子结合为化合物的形成过程: ;
;
(4)元素④的最高价氧化物的水化物的稀溶液与Cu发生反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO+4H2O;
(5)写出元素⑤单质在常温下为气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-═2Cl-+ClO-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ⑧ | |||||
| 3 | ② | ⑤ | ⑥ | |||||
| 4 | ⑦ |
(2)元素①和⑧可以形成的化合物,其中原子个数比为1:1的化合物的结构式为H-O-O-H化学键类型为极性键非极性键
元素②和⑧可以形成的化合物,其中原子个数比为1:1的化合物的电子式为

(3)用电子式表示⑤和②原子结合为化合物的形成过程:
 ;
;(4)元素④的最高价氧化物的水化物的稀溶液与Cu发生反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO+4H2O;
(5)写出元素⑤单质在常温下为气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-═2Cl-+ClO-+2H2O.


 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
 .
. .
.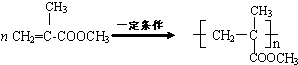 .
.