题目内容
氯化钾样品中含有少量碳酸钾、亚硫酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作.已知B、C是难溶于水的物质,B是混合物,其中含有C.回答下列问题:

(1)取少量滤液(样品溶于水并过滤后的溶液)滴入溴水中,溴水立即褪色,写出滤液与溴水反应的离子方程式: .
(2)试剂I的化学式为 ,图中①处过滤后得到沉淀B,沉淀B如需洗涤,检验洗涤是否干净的方法是
.
(3)②中加入试剂II的目的是 ,试剂III的名称是 .
(4)E经过加热蒸发,待有晶体析出并剩余少量液体时停止加热,用余热蒸干即可得到KCI晶体,此项操作中要用到的仪器:
酒精灯、铁架台(带铁圈)、 、 .
(5)选用下列试剂,可以检验B的混合物中含有C,试剂的正确使用顺序是 .
可能用到的试剂(如有需要试剂可以重复使用):A.品红溶液 B.澄清石灰水 C.饱和碳酸氢钠溶液 D.酸性高锰酸钾 E.稀盐酸 F.氢氧化钠溶液.

(1)取少量滤液(样品溶于水并过滤后的溶液)滴入溴水中,溴水立即褪色,写出滤液与溴水反应的离子方程式:
(2)试剂I的化学式为
(3)②中加入试剂II的目的是
(4)E经过加热蒸发,待有晶体析出并剩余少量液体时停止加热,用余热蒸干即可得到KCI晶体,此项操作中要用到的仪器:
酒精灯、铁架台(带铁圈)、
(5)选用下列试剂,可以检验B的混合物中含有C,试剂的正确使用顺序是
可能用到的试剂(如有需要试剂可以重复使用):A.品红溶液 B.澄清石灰水 C.饱和碳酸氢钠溶液 D.酸性高锰酸钾 E.稀盐酸 F.氢氧化钠溶液.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验题
分析:滤液中含有KCl、K2CO3、K2SO3、K2SO4,向滤液中加入过量BaCl2溶液,发生反应CO32-+Ba2+=BaCO3↓、SO32-+Ba2+=BaSO3↓、SO42-+Ba2+=BaSO4↓,得到固体B为BaCO3、BaSO3、BaSO4,滤液中含有KCl、BaCl2,向滤液中加入过量K2CO3,除去过量的钡离子,得到固体C为BaCO3,D中溶质为K2CO3和KCl,然后向溶液中加入过量HCl,发生反应 CO32-+2H+=H2O+CO2↑,然后蒸发溶液,溶液中HCl挥发,所以最终得到KCl晶体,以此解答该题.
解答:
解:滤液中含有KCl、K2CO3、K2SO3、K2SO4,向滤液中加入过量BaCl2溶液,发生反应CO32-+Ba2+=BaCO3↓、SO32-+Ba2+=BaSO3↓、SO42-+Ba2+=BaSO4↓,得到固体B为BaCO3、BaSO3、BaSO4,滤液中含有KCl、BaCl2,向滤液中加入过量K2CO3,除去过量的钡离子,得到固体C为BaCO3,D中溶质为K2CO3和KCl,然后向溶液中加入过量HCl,发生反应 CO32-+2H+=H2O+CO2↑,然后蒸发溶液,溶液中HCl挥发,所以最终得到KCl晶体,
(1)滤液中含有亚硫酸钾,具有还原性,可与溴发生氧化还原反应,反应的方程式为Br2+SO32-+H2O=2H++SO42-+2Br-,故答案为:Br2+SO32-+H2O=2H++SO42-+2Br-;
(2)由以上分析可知试剂I为BaCl2,得到固体B为BaCO3、BaSO3、BaSO4,固体表面可吸附氯离子等,检验沉淀是否洗涤干净,可取最后一次洗涤液,加入少量硝酸银溶液,无现象说明洗涤干净,
故答案为:BaCl2;取最后一次洗涤液,加入少量硝酸银溶液,无现象说明洗涤干净;
(3)试剂Ⅱ为K2CO3,可除去过量的钡离子,试剂Ⅲ为稀盐酸,可用于除去过量的碳酸钾,
故答案为:除去多余的钡离子;稀盐酸;
(4)蒸发用到的仪器有酒精灯、铁架台(带铁圈)、蒸发皿、玻璃棒,
故答案为:蒸发皿;玻璃棒;
(5)C为BaCO3,可与酸反应生成二氧化碳气体,但由于B中含有BaSO3,加入酸可生成二氧化硫气体,检验时应先除去二氧化硫,一般做法是先加盐酸,将气体通过高锰酸钾溶液除去二氧化硫,可用品红检验二氧化硫是否除尽,然后用澄清石灰水检验是否生成二氧化碳,顺序可为EDAB或EADAB或EDB,
故答案为:EDAB或EADAB或EDB.
(1)滤液中含有亚硫酸钾,具有还原性,可与溴发生氧化还原反应,反应的方程式为Br2+SO32-+H2O=2H++SO42-+2Br-,故答案为:Br2+SO32-+H2O=2H++SO42-+2Br-;
(2)由以上分析可知试剂I为BaCl2,得到固体B为BaCO3、BaSO3、BaSO4,固体表面可吸附氯离子等,检验沉淀是否洗涤干净,可取最后一次洗涤液,加入少量硝酸银溶液,无现象说明洗涤干净,
故答案为:BaCl2;取最后一次洗涤液,加入少量硝酸银溶液,无现象说明洗涤干净;
(3)试剂Ⅱ为K2CO3,可除去过量的钡离子,试剂Ⅲ为稀盐酸,可用于除去过量的碳酸钾,
故答案为:除去多余的钡离子;稀盐酸;
(4)蒸发用到的仪器有酒精灯、铁架台(带铁圈)、蒸发皿、玻璃棒,
故答案为:蒸发皿;玻璃棒;
(5)C为BaCO3,可与酸反应生成二氧化碳气体,但由于B中含有BaSO3,加入酸可生成二氧化硫气体,检验时应先除去二氧化硫,一般做法是先加盐酸,将气体通过高锰酸钾溶液除去二氧化硫,可用品红检验二氧化硫是否除尽,然后用澄清石灰水检验是否生成二氧化碳,顺序可为EDAB或EADAB或EDB,
故答案为:EDAB或EADAB或EDB.
点评:本题以混合物的分离和提纯为载体考查了无机物推断,明确物质的性质是解本题关键,根据物质之间的反应、离子的检验方法、物质分离和提纯的方法等知识点来分析解答,难点是除杂剂的选取及滴加顺序,题目难度中等.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
乙醇与钠反应的现象描述正确的是( )
| A、浮在乙醇面上,融化成闪亮的小球 |
| B、沉到乙醇底部,融化成闪亮的小球 |
| C、沉到乙醇底部,缓慢产生气泡,钠不融化 |
| D、浮在乙醇面上,钠不融化但四处游动 |
下列化学用语正确的是( )
A、HCl的电子式: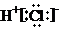 |
| B、C-12原子:12C |
| C、乙酸的结构简式:C2H4O2 |
| D、NH3?H2O的电离方程式:NH3?H2O→NH4++OH- |
将甲基、羟基、羧基和苯基四种原子团,两两结合形成的有机物中,其水溶液能与氢氧化钠溶液反应的有( )
| A、2种 | B、3种 | C、4种 | D、5种 |

 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据: