题目内容
下列说法正确的是( )
| A、纸上层析属于色谱分析法,其原理跟“毛细现象”相关,通常以滤纸作为惰性支持物,水作为固定相 |
| B、重结晶时,溶液冷却速度越慢得到的晶体颗粒越小 |
| C、用新制的Cu(OH)2浊液可以检验牙膏中的甘油,生成绛蓝色沉淀 |
| D、将3~4根火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液和稀HNO3,可以检验火柴头中的氯元素 |
考点:物质的分离、提纯的基本方法选择与应用,物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题,化学实验基本操作
分析:A.展开剂之所以能够展开与毛细现象有关;
B.若将滤液静置并缓缓降温,得到的晶体较大;
C.生成络离子,不是沉淀;
D.火柴头浸于水中不含氯离子.
B.若将滤液静置并缓缓降温,得到的晶体较大;
C.生成络离子,不是沉淀;
D.火柴头浸于水中不含氯离子.
解答:
解:A.纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,常用滤纸作载体,滤纸上所吸收的水分作固定相,有机溶剂作流动相,当流动相流过固定相时,各组分以不同的速度移动,从而使混合物分离,其原理跟“毛细现象”相关,故A正确;
B.一般说来,若将滤液迅速冷却并剧烈搅拌,则所析出的晶体很细,总表面积大,因而表面上吸附或粘附的母液总量也较多.若将滤液静置并缓缓降温,得到的晶体较大,故B错误;
C.加入新制的Cu(OH)2悬浊液与甘油反应得到深蓝色透明溶液,故C错误;
D.火柴头浸于水中不含氯离子,应将燃尽的火柴头浸泡在少量水中产生氯离子,再加AgNO3溶液和稀HNO3,可以检验火柴头中的氯元素,故D错误;
故选A.
B.一般说来,若将滤液迅速冷却并剧烈搅拌,则所析出的晶体很细,总表面积大,因而表面上吸附或粘附的母液总量也较多.若将滤液静置并缓缓降温,得到的晶体较大,故B错误;
C.加入新制的Cu(OH)2悬浊液与甘油反应得到深蓝色透明溶液,故C错误;
D.火柴头浸于水中不含氯离子,应将燃尽的火柴头浸泡在少量水中产生氯离子,再加AgNO3溶液和稀HNO3,可以检验火柴头中的氯元素,故D错误;
故选A.
点评:本题考查物质分离提纯,为高频考点,题目涉及较广,题目难度中等,答题时注意审题,牢固把握相关基础知识是解答该题的前提.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L H2O含有的分子数为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、在0.5mol?/L的MgSO4溶液中,Mg2+数目为0.5NA |
依据 ①2Fe2++Cl2=2Fe3++2Cl-
②2Fe3++Cu=2Fe2++Cu2+
③Fe+Cu2+=Fe2++Cu
上述反应判断氧化剂的氧化性强弱顺序正确的是( )
②2Fe3++Cu=2Fe2++Cu2+
③Fe+Cu2+=Fe2++Cu
上述反应判断氧化剂的氧化性强弱顺序正确的是( )
| A、Cl2>Fe3+>Cu2+ |
| B、Fe3+>Cl2>Cu2+ |
| C、Cu2+>Fe3+>Cl2 |
| D、Cl2>Cu2+>Fe3+ |
下列变化过程,属于放热过程的是( )
①铝热反应 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌.
①铝热反应 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌.
| A、①③⑤ | B、①②③④⑤ |
| C、②③④⑤ | D、①⑥⑦ |
下列各组粒子中核外电子总数相等的是( )
| A、K+ 和 Na+ |
| B、CO2和NO2 |
| C、CO和CO2 |
| D、NH2- 和CH5+ |
下列关于有机物的说法中,正确的是( )
| A、乙烯、苯、乙醇均能使紫色的酸性高锰酸钾溶液褪色 |
| B、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| C、油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 |
| D、乙酸乙酯、油脂、果糖、蛋白质都可以发生水解反应 |
下列条件下,可能大量共存的离子组是( )
| A、常温下水电离的c(OH-)为1×10-10 mol/L的溶液中:AlO2-、CO32-、K+、Na+ |
| B、常温下溶液中的c( H+)为1×10-5 mol/L的溶液中:S2-、SO42-、S2O32-、K+ |
| C、在含有Fe3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+ |
| D、在含有KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl-、Br- |
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、0.1 mol Fe与足量盐酸反应,转移的电子数为0.3NA |
| B、0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA |
| C、标况下,22.4L汽油的分子数为NA |
| D、常温常压下,36.5g HCl溶于水形成1L溶液,其物质的量浓度为1 mol?L-1 |
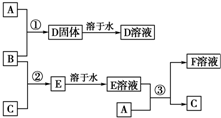 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的.
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的.