题目内容
下表列出了A-K 11种元素在元素周期表中的位置,用化学用语回答下列问题:
(1)在这11种元素中,最活泼的金属,其元素符号是 ;最不活泼的元素,其元素符号是 ;E元素位于周期表中的位置是: .
(2)C、D、E三种元素的氧化物对应的水化物,其中碱性最强的化学式是 ,该化合物中含有的化学键是 和 .
(3)A、B、G 的原子半径由大到小的顺序为
(4)F、G、H 的最高价含氧酸的酸性由强到弱的顺序是 .
(5)最高价氧化物的水化物呈两性的是 ,气态氢化物稳定性最强的是 .
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | A | B | K | |||||
| 3 | C | D | E | F | G | H | I | |
| 4 | J |
(2)C、D、E三种元素的氧化物对应的水化物,其中碱性最强的化学式是
(3)A、B、G 的原子半径由大到小的顺序为
(4)F、G、H 的最高价含氧酸的酸性由强到弱的顺序是
(5)最高价氧化物的水化物呈两性的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为碳、B为氧、K为氟、C为Na、D为Mg、E为Al、F为磷、G为硫、H为Cl、I为Ar、J为钾.
(1)同周期随原子序数增大,元素金属性减弱,同主族自上而下金属性增强;稀有气体化学性质最不活泼;由E元素位于周期表中的位置,可知其位于第三周期第ⅢA族;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)同周期自左而右原子半径减小,电子层越多原子半径越大;
(4)非金属性越强,最高价含氧酸的酸性越强;
(5)氢氧化铝属于两性氢氧化物;上述元素中氟元素非金属性最强,其氢化物最稳定.
(1)同周期随原子序数增大,元素金属性减弱,同主族自上而下金属性增强;稀有气体化学性质最不活泼;由E元素位于周期表中的位置,可知其位于第三周期第ⅢA族;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)同周期自左而右原子半径减小,电子层越多原子半径越大;
(4)非金属性越强,最高价含氧酸的酸性越强;
(5)氢氧化铝属于两性氢氧化物;上述元素中氟元素非金属性最强,其氢化物最稳定.
解答:
解:由元素在周期表中位置,可知A为碳、B为氧、K为氟、C为Na、D为Mg、E为Al、F为磷、G为硫、H为Cl、I为Ar、J为钾.
(1)同周期随原子序数增大,元素金属性减弱,同主族自上而下金属性增强,故上述元素中K的金属性最强;稀有气体Ar的化学性质最不活泼;由E元素位于周期表中的位置,可知其位于第三周期第ⅢA族,
故答案为:K;Ar;第三周期第ⅢA族;
(2)同周期自左而右金属性增强,故金属Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,含有离子键、共价键,
故答案为:NaOH;离子键、共价键;
(3)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:S>C>O,
故答案为:S>C>O;
(4)同周期自左而右非金属性增强,故非金属性Cl>S>P,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4>H3PO4,
故答案为:HClO4>H2SO4>H3PO4;
(5)Al(OH)3属于两性氢氧化物;上述元素中氟元素非金属性最强,其氢化物HF最稳定,
故答案为:Al(OH)3;HF.
(1)同周期随原子序数增大,元素金属性减弱,同主族自上而下金属性增强,故上述元素中K的金属性最强;稀有气体Ar的化学性质最不活泼;由E元素位于周期表中的位置,可知其位于第三周期第ⅢA族,
故答案为:K;Ar;第三周期第ⅢA族;
(2)同周期自左而右金属性增强,故金属Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,含有离子键、共价键,
故答案为:NaOH;离子键、共价键;
(3)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:S>C>O,
故答案为:S>C>O;
(4)同周期自左而右非金属性增强,故非金属性Cl>S>P,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4>H3PO4,
故答案为:HClO4>H2SO4>H3PO4;
(5)Al(OH)3属于两性氢氧化物;上述元素中氟元素非金属性最强,其氢化物HF最稳定,
故答案为:Al(OH)3;HF.
点评:本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意对基础知识的理解掌握.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列说法正确的是( )
| A、进行纸层析操作时,要让层析试纸上的点样点进入展开剂,进行展开 |
| B、在酸性K2Cr2O7溶液中滴加亚硝酸钠溶液,溶液会变绿色 |
| C、乙酸和乙醇的混合液可用分夜漏斗进行分离 |
| D、用盐酸标准液滴定待测的氢氧化钠时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
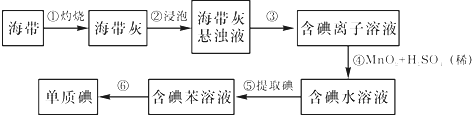
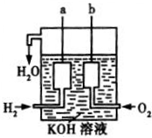 化学反应产生的各种能量是人类探索太空所需能量的重要来源.
化学反应产生的各种能量是人类探索太空所需能量的重要来源.