题目内容
17.下列说法中不正确的是( )| A. | 2014年11月10日APCE国宴采用的帝王彩瓷餐具和常见的水晶饰品都属于硅酸盐制品 | |
| B. | 20mL0.1mol•L-1NaOH分别与10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者放出的热量比后者少 | |
| C. | Na2SO4•10H2O$?_{冷却}^{受热}$Na2SO4+10H2O利用该反应可以实现太阳能和化学能的相互转换 | |
| D. | 浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的 |
分析 A.水晶的主要成分为二氧化硅;
B.醋酸为弱电解质,电离需要吸收热量;
C.芒硝就是十水硫酸钠.温度较高时,脱去结晶水,是吸热过程,低温下,结合结晶水,是放热过程;
D.硫酸在水溶液中解离,须有水分子参与,形成的实质上并非氢离子和硫酸根,而是这两种离子的水合态,而浓硫酸中含有极少的水,不足以大量形成水和离子,故以硫酸分子形式存在.
解答 解:A.水晶的主要成分为二氧化硅,不属于硅酸盐材料,故A错误;
B.10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者浓度较大,电离吸收热量多,与20mL0.1mol•L-1NaOH都能反应,放出的中和热相同,但是前者吸收热量多,所以最终放出热量少,故B正确;
C.芒硝就是十水硫酸钠.温度较高时,脱去结晶水,是吸热过程,低温下,结合结晶水,是放热过程.因此可以利用这个原理储备和放出热量,实现太阳能和化学能的相互转换,故C正确;
D.浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的,故D正确;
故选:A.
点评 本题为综合题,考查了硅酸盐材料的成分,反应的热效应、浓硫酸的性质,题目难度中等,熟悉相关知识是解题关键.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
8.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)除稀有气体外,元素中原子半径最大的是K,其离子的结构示意图为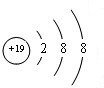
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为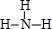 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为
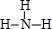 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
2.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
(1)推测反应Ⅲ是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2-t4内 c(N2)的变化曲线.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2-t4内 c(N2)的变化曲线.
9.现有六种元素,其中A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
13.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
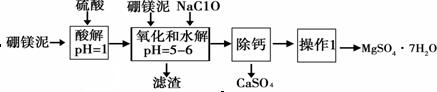
根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤蒸发浓缩、趁热过滤.
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.

根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.
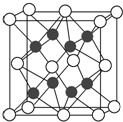 化合物Na2O的晶胞如图.
化合物Na2O的晶胞如图.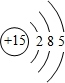 ;
;
 )有还原性,易被氧化;
)有还原性,易被氧化; .
.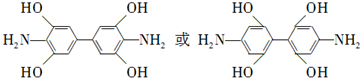 .
. )是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下: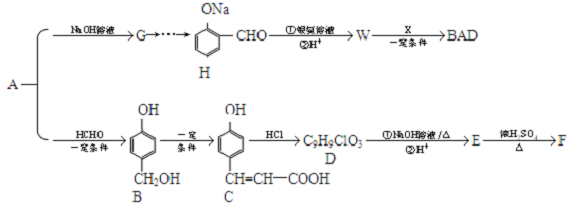
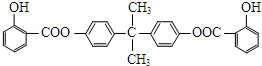
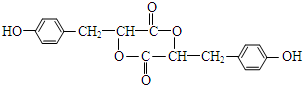
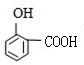 .
.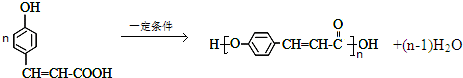 .
. .
.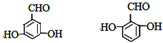 (其中一种).
(其中一种).