题目内容
17. 将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热△H=-1940kJ•mol-1.
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO${\;}_{3}^{2-}$-12e-=8CO2+3H2O.写出该燃料电池的正极反应式:O2+4e-+2CO2=2CO32-.
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2.某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为Co2+-e-=Co3+.
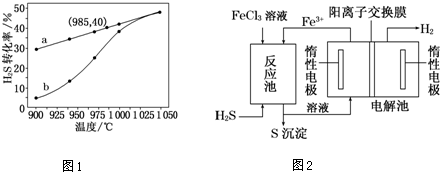
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气.
①电解池中电极A、B均为惰性电极,其中A为电解池的B极;电极B所得到的物质X的分子式为H2.
②反应池中发生的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+.
分析 (1)根据反应热能与反应物的总键能减生成物的总键能计算;
(2)①燃料电池中,正极上氧化剂得电子发生还原反应;
②电解池中阳极失电子发生氧化反应;
(3)①A极生成铁离子,B极生成气体,可知A为阳极,B为阴极;
②反应池中铁离子和硫化氢反应生成硫,则铁离子被还原.
解答 解:(1)在反应CH4(g)+4F2(g)=CF4(g)+4HF(g)中,△H=(4×414+4×155)kJ•mol-1-(4×489+4×565)kJ•mol-1=-1940 kJ•mol-1,
故答案为:-1940 kJ•mol-1;
(2)①燃料电池中,正极上氧化剂氧气得电子和二氧化碳发生还原反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
②通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+,故答案为:Co2+-e-=Co3+;
(3)①A极生成铁离子,B极生成气体,可知A为阳极,B为阴极,B极生成气体为氢气,故答案为:阳; H2;
②反应池中铁离子和硫化氢反应生成硫,则铁离子被还原,离子方程式为H2S+2Fe3+=2Fe2++S↓+2H+,故答案为:H2S+2Fe3+=2Fe2++S↓+2H+.
点评 本题考查较为综合,涉及反应热、原电池、电解池等知识,为高考常见题型和高频考点,题目综合性强,难度较大,注重了高考常考考点的考查,注意知识的迁移应用和信息的处理.

练习册系列答案
相关题目
7.下列离子方程式正确的是( )
| A. | NaOH溶液中通入少量CO2:CO2+OH-═HCO3- | |
| B. | 碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-NH3↑+H2O | |
| C. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
8.下列各项化学用语表达正确的是( )
| A. | NaCl的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的分子模型示意图: | D. | O2-的离子结构示意图: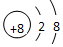 |
5.下列物质的转化在给定条件下能实现的是( )
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | MgO$\stackrel{H_{2}SO_{4}}{→}$MgSO4(aq)$\stackrel{电解}{→}$Mg | |
| C. | 饱和NaCl(aq)$\underset{\stackrel{①N{H}_{3}}{→}}{②C{O}_{2}}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
2.下列说法不正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 油脂水解生成甘油和高级脂肪酸或高级脂肪酸盐 | |
| C. | 淀粉水解的最终产物是葡萄糖 | |
| D. | 重油裂解可以得到汽油 |
9.下列反应的离子方程式正确的是( )
| A. | 硫化亚铁中加入稀硫酸 2H++S2-→H2S↑ | |
| B. | 向苯酚钠溶液中通入少量的CO2 -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- | |
| C. | 向碳酸氢钠溶液中滴入少量石灰水 HCO3-+Ca2++OH-→CaCO3↓+H2O | |
| D. | 向明矾溶液中加入过量的氨水 A13++3NH3•H2O→Al(OH)3↓+3NH4+ |
6.仪器名称为“蒸发皿”的是( )
| A. |  | B. |  | C. |  | D. |  |

 .
. .
.