题目内容
9.化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答.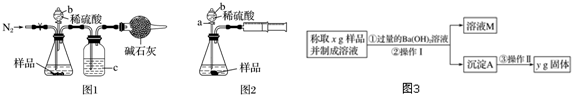
(1)甲同学用图1所示装置测定CO2的质量.实验时稀硫酸是与样品中的Na2CO3(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是分液漏斗,洗气瓶c中盛装的是浓硫酸.实验开始前,打开止水夹,先通入N2,通入N2的作用是实验前排除装置中的二氧化碳;一会后,连接上干燥管,打开b的活塞,滴下稀硫酸,充分反应后,再通入N2的目的将反应中生成的二氧化碳全部鼓入干燥管中.
(2)乙同学用图2所示装置,取一定质量的样品(m g)和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定.
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的液面上升,则装置气密性良好.
②在实验完成时,能直接测得的数据是CO2的体积(填“体积”或“质量”).
(3)丙同学用如图3所示方法和步骤进行实验:
①操作Ⅰ涉及的实验名称有过滤、洗涤;操作Ⅱ涉及的实验名称有干燥、称量.
②丙同学测得的样品中Na2CO3质量分数的计算式为$\frac{106y}{197x}$×100%.
分析 (1)依据装置和试剂分析,硫酸和样品中的碳酸钠反应,仪器b是加入液体的仪器可以控制加入的量,是分液漏斗;反应过程中含有水蒸气,可以利用浓硫酸干燥二氧化碳气体;实验开始前,打开止水夹,先通入N2,将装置中的空气排尽,减小空气中的二氧化碳对实验结果的干扰,实验结束时继续通氮气,将装置中的二氧化碳排出,使二氧化碳充分被吸收;
(2)①使用注射器改变瓶内气体的多少而改变瓶内压强;当将针筒活塞向内推压时,瓶内气体被压缩,压强增大,瓶内液体则会被压入长颈漏斗内,b下端玻璃管中液面上升,可以说明装置气密性良好;
②装置中 加入硫酸和碳酸钠反应生成二氧化碳,注射器活塞被向外推出,可以测定二氧化碳的体积;
(3)①依据流程分析可知,加入氢氧化钡溶液和碳酸钠 反应生成碳酸钡沉淀,通过过滤得到沉淀,洗涤后称重得到沉淀碳酸钡质量;
②依据沉淀质量计算物质的量,依据碳元素守恒计算碳酸钠质量,计算样品中碳酸钠的质量分数.
解答 解:(1)依据装置和试剂分析,硫酸和样品中的碳酸钠反应,仪器b是加入液体的仪器可以控制加入的量,是分液漏斗;反应过程中含有水蒸气,可以利用浓硫酸干燥二氧化碳气体,实验开始前,打开止水夹,先通入N2,将装置中的空气排尽,减小空气中的二氧化碳对实验结果的干扰,实验结束时继续通氮气,将装置中的二氧化碳排出,使二氧化碳充分被吸收,
故答案为:Na2CO3;分液漏斗;浓硫酸;实验前排除装置中的二氧化碳;将反应中生成的二氧化碳全部鼓入干燥管中;
(2)①使用注射器改变瓶内气体的多少而改变瓶内压强;当将针筒活塞向内推压时,瓶内气体被压缩,压强增大,瓶内液体则会被压入长颈漏斗内,b下端玻璃管中液面上升,可以说明装置气密性良好,
故答案为:液面上升;
②在实验完成时,反应后可以利用注射器读取生成气体的体积,能直接测得的数据是CO2的体积,
故答案为:体积;
(3)①流程分析可知,加入氢氧化钡溶液和碳酸钠 反应生成碳酸钡沉淀,通过过滤得到沉淀,洗涤后称重得到沉淀碳酸钡质量,
故答案为:过滤;称量;
②流程分析判断沉淀质量为yg,物质的量=$\frac{yg}{197g/mol}$=$\frac{y}{197}$mol;碳酸钠物质的量和碳酸钡物质的量相同,样品质量为Xg,则碳酸钠质量为$\frac{y}{197}$mol×106g/mol;
所以碳酸钠的质量分数=$\frac{\frac{106y}{197}}{x}$×100%=$\frac{106y}{197x}$×100%,
故答案为:$\frac{106y}{197x}$×100%.
点评 本题考查了物质性质的实验验证和含量测定方法分析判断,混合物中物质质量分数的计算方法和应用,题目难度中等,答题时注意元素化合物知识和实验基本操作的灵活运用.

 阅读快车系列答案
阅读快车系列答案| A. | 将移液管里下端残液吹入锥形瓶 | |
| B. | 滴定时向锥形瓶中加入少量的蒸馏水后继续滴定 | |
| C. | 滴定管用蒸馏水洗涤后未用标准碱液润洗就装入标准碱液进行滴定 | |
| D. | 用酚酞作指示剂 |
| A. | CO32- | B. | SO42- | C. | Cl- | D. | Na+ |
| A. | 称量时,左盘高,右盘低 | B. | 定容时,俯视读取刻度 | ||
| C. | 容量瓶洗净后未干燥 | D. | 定容时,液面超过了刻度线 |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
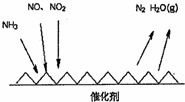 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.