题目内容
16.在①CH4、②CH2=CH2、③CH3CH2OH三种有机物中,属于天然气主要成分的是①(填序号,下同),俗称“酒精”的是③,可用于合成聚乙烯塑料的是②.分析 天然气的主要成分为甲烷,乙醇的俗名为酒精,乙烯可发生加聚反应生成聚乙烯塑料,以此来解答.
解答 解:在①CH4、②CH2=CH2、③CH3CH2OH三种有机物中,属于天然气主要成分的是①,俗称“酒精”的是③,可用于合成聚乙烯塑料的是②,
故答案为:①;③;②.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、性质与用途为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.

练习册系列答案
相关题目
11.已知 25℃时部分弱电解质的电离平衡常数数据如表:
回答下列问题:
(4)写出碳酸的第一级电离平衡常数表达式:K1=$\frac{[HC{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}C{O}_{3}]}$.
(2)25℃时,等物质的量浓度的 a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的 pH 由大到小的顺序为cbda (填字母).
(3)常温下,0.1mol•L-1的 CH3COOH 溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)
A.[H+]B.$\frac{{H}^{+}}{C{H}_{3}COOH}$ C.[H+]•[OH-]D.$\frac{O{H}^{-}}{{H}^{+}}$
(4)25℃时,将 20mL 0.1 mol•L-1 CH3COOH 溶液和 20mL 0.1 mol•L-1HSCN 溶液分别与 20mL 0.1 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”).

(5)体积均为 100mL pH=2 的 CH3COOH 与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图2所示,则 HX 的电离平衡常数小于(填“大于”、“小于”或“等于”)CH3COOH 的电离平衡常数.
(6)25℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,
则溶液中 c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
(7)写出少量 CO2通入次氯酸钠溶液中的离子方程式:CO2+H2O+ClO-=HCO3-+HClO.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10 -1 | 1.7×10 -5 | 6.2×10 -10 | K1=4.3×10-7 K2=5.6×10-11 |
(4)写出碳酸的第一级电离平衡常数表达式:K1=$\frac{[HC{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}C{O}_{3}]}$.
(2)25℃时,等物质的量浓度的 a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的 pH 由大到小的顺序为cbda (填字母).
(3)常温下,0.1mol•L-1的 CH3COOH 溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)
A.[H+]B.$\frac{{H}^{+}}{C{H}_{3}COOH}$ C.[H+]•[OH-]D.$\frac{O{H}^{-}}{{H}^{+}}$
(4)25℃时,将 20mL 0.1 mol•L-1 CH3COOH 溶液和 20mL 0.1 mol•L-1HSCN 溶液分别与 20mL 0.1 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”).

(5)体积均为 100mL pH=2 的 CH3COOH 与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图2所示,则 HX 的电离平衡常数小于(填“大于”、“小于”或“等于”)CH3COOH 的电离平衡常数.
(6)25℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,
则溶液中 c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
(7)写出少量 CO2通入次氯酸钠溶液中的离子方程式:CO2+H2O+ClO-=HCO3-+HClO.
1.下列有关实验操作的叙述中不正确的是( )
| A. | 少量白磷贮存在水中,切割时再取出放在干燥玻璃片下进行 | |
| B. | 不慎接触到过多氨时,要及时吸入新鲜空气和水蒸气 | |
| C. | 硝酸不慎滴在手上要立刻用大量水冲洗,再用小苏打水或肥皂洗涤 | |
| D. | 酒精灯在桌上歪倒失火后,立即用湿布盖下 |
8.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 1mol碳正离子CH3+所含的电子数为6NA | |
| C. | 室温下的乙烯和丁烯共21.0g,其中碳原子数为1.5NA | |
| D. | 标准状况下,1L 庚烷完全燃烧后,所生成的气态产物分子数为$\frac{7}{22.4}$NA |
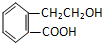 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
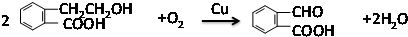 ;氧化反应;
;氧化反应; ;酯化反应;
;酯化反应; $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.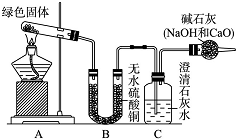 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.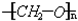 ,是通过加聚反应制得的,合成人造象牙的单体是HCHO
,是通过加聚反应制得的,合成人造象牙的单体是HCHO