题目内容
8.下列说法正确的是( )| A. | 吸热反应在一定条件下也能发生 | |
| B. | 放热的反应在常温下一定很易发生 | |
| C. | 反应是吸热还是放热必须看反应物和生成物具有的总质量的相对大小 | |
| D. | 需加热方能发生的反应一定是吸热反应 |
分析 A、吸热反应也能发生;
B、放热反应不一定在常温下就能发生;
C、反应吸放热取决于反应物总能量和生成物的总能量的相对大小;
D、反应条件和反应吸放热无关.
解答 解:A、吸热反应也能发生,且不一定需要加热,有的在常温下即可进行,故A正确;
B、放热反应不一定在常温下就能发生,如煤炭的燃烧为放热反应,但必须加热才能进行,故B错误;
C、反应吸放热取决于反应物总能量和生成物的总能量的相对大小,和反应物、生成物的质量无关,故C错误;
D、反应条件和反应吸放热无必然联系,即需要加热才能进行的不一定是吸热反应,吸热反应不一定需要加热,故D错误.
故选A.
点评 本题考查了反应吸放热的决定性因素--反应物和生成物的总能量的相对大小以及反应条件和反应吸放热的关系,难度不大,注意反应条件和反应吸放热无必然联系.

练习册系列答案
相关题目
18.物质的变化千奇百怪,但概括起来就两大类,即物理变化和化学变化,下列说法正确的是( )
| A. | 有化学键破坏的变化一定属于化学变化 | |
| B. | 发生了颜色变化的一定是化学变化 | |
| C. | 有气泡产生或沉淀析出的变化一定是化学变化 | |
| D. | 燃烧一定是化学变化 |
19.据报道,挪威和荷兰正在开发一种新能源--盐能.当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%,海水和淡水混合时,温度升高最可能的原因是( )
| A. | 由于浓度差产生放热 | B. | 发生了水分解反应 | ||
| C. | 发生了盐分解反应 | D. | 盐的溶解程度增大 |
16.硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.
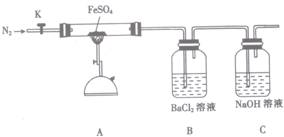
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为Fe2O3.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N.
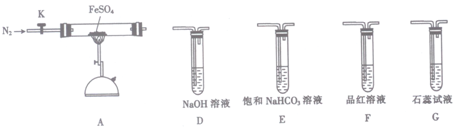
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→F→D.
②能证明生成了非金属氧化物N的现象是F中品红溶液褪色.

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为Fe2O3.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中①有白色沉淀生成 | ②SO3+H2O+BaCl2=BaSO4↓+2HCl |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③有红棕色固体物质生成 | ④2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑ |

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→F→D.
②能证明生成了非金属氧化物N的现象是F中品红溶液褪色.
13.下列说法错误的是( )
| A. | H2O2、Na2O2都属于过氧化物,都存在共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
20.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-):c(H+)=1012,将这两种溶液等体积混合,以下离子浓度关系判断正确的是( )
| A. | c(H+)<c(OH-)<c(B+)<c(A-) | B. | c(H+)<c(OH-)<c(A-)<c(B+) | ||
| C. | c(OH-)<c(H+)<c(B+)<c(A-) | D. | c(A-)=c(B+)>c(H+)=c(OH-) |
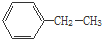 乙苯 ②
乙苯 ②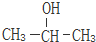 2-丙醇
2-丙醇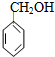 苯甲醇 ④
苯甲醇 ④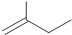 2-甲基-1-丁烯
2-甲基-1-丁烯 ③二乙酸乙二酯
③二乙酸乙二酯 ④甘氨酸H2NCH2COOH.
④甘氨酸H2NCH2COOH.