题目内容
已知1mol N2(气态)与适量H2(气态)反应,生成NH3(气态),放出92kJ的热量,且形成1mol N-H键时放出391kJ的热量,完全断裂1mol H-H键吸收436kJ的热量,则1mol N2断键时吸收热量为( )
| A、946 kJ |
| B、135 kJ |
| C、1130 kJ |
| D、780 kJ |
考点:反应热和焓变
专题:
分析:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算.
解答:
解:在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量与生成2mol NH3,共形成6mol N-H键,放出的能量的差值即为焓变,则有:Q( N三N)+3×436KJ-6×391KJ=-92KJ,所以Q( N三N)=946KJ,故选:A.
点评:本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
相关题目
对某物质进行试验:(1)能与碱反应生成盐与水;(2)该物质的水溶液能与铁反应生成氢气;(3)该物质的水溶液中阳离子只有H+,据你学过的酸的概念,下列判断正确的是( )
| A、(1)(2)(3)均能说明该物质是酸 |
| B、(1)(2)(3)均不能说明该物质是酸 |
| C、只有(3)能说明该物质是酸 |
| D、(2)(3)能说明该物质是酸 |
某同学写出的下列烷烃的名称中,不正确的是( )
| A、3-甲基-2-乙基戊烷 |
| B、3,3-二甲基己烷 |
| C、2,3-二甲基丁烷 |
| D、2,2,3,3-四甲基丁烷 |
下列说法正确的是( )
A、按系统命名法命名时,图 的名称是3,5,7-三甲基-6-乙基辛烷 的名称是3,5,7-三甲基-6-乙基辛烷 |
B、有机物 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 |
| C、等质量的乙酸甲酯和甲酸乙酯完全燃烧生成水的量相等 |
D、高分子化合物 ,其单体为对苯二甲酸和乙醇 ,其单体为对苯二甲酸和乙醇 |
下列物质既可以与碳酸钠反应,又可以与碳酸氢钠反应,生成沉淀的是( )
| A、NaOH溶液 |
| B、CaCl2溶液 |
| C、Ca(OH)2溶液 |
| D、硝酸 |
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),达到平衡时,测的A的浓度为0.5mol/L,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测的A的浓度降低为0.3mol/L,下列有关判断正确的是( )
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、C的体积分数下降 |
| D、A的转化率提高 |
下列关于热化学反应的描述中正确的是( )
| A、CO燃烧是吸热反应 |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol |
| D、1mol CH4燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
下列有关物质分离的实验:①用渗析法分离蛋白质和葡萄糖的混合液 ②用盐析法分离油脂皂化反应的产物 ③用升华法分离碘和砂子的混合物 ④用分液法分离已烷和水的混合物 ⑤用结晶法分离硝酸钾和氯化钠的混合物 ⑥用蒸馏法分离酒精与苯酚钠的混合物.你认为( )
| A、只有①不正确 |
| B、②④⑥不正确 |
| C、只有③⑤⑥正确 |
| D、全部正确 |
下列装置或操作错误,不能达到实验目的是( )
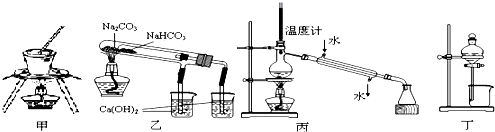

| A、用甲图装置可用于加热、灼烧固体 |
| B、用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
| C、用丙图装置分离乙醇与水 |
| D、用丁图装置可由四氯化碳萃取碘水中的碘 |