题目内容
下列物质的分类结果全部正确的是( )
| A、CO--酸性氧化物 Na2O2--碱性氧化物 Al2O3--两性氧化物 |
| B、漂白粉--混合物 胆矾--纯净物 HD--单质 |
| C、纯碱--碱 硫化氢--酸 小苏打--酸式盐 |
| D、盐酸--强电解质 硫酸钡--强电解质 醋酸--弱电解质 |
考点:酸、碱、盐、氧化物的概念及其相互联系,混合物和纯净物,强电解质和弱电解质的概念
专题:物质的分类专题
分析:A、酸性氧化物是能和碱反应生成盐和水的氧化物;碱性氧化物是指能和酸生成盐和水的氧化物;
B、漂白粉是CaCl2和Ca(ClO)2的混合物,胆矾是CuSO4?5H2O,HD即氢气;
C、碱是电离出的阴离子全部是氢氧根的化合物;酸即电离出的阳离子全部是氢离子的化合物;小苏打即NaHCO3;
D、强电解质是指在水溶液中能完全电离的化合物;弱电解质是指在水溶液中不能全部电离的化合物.
B、漂白粉是CaCl2和Ca(ClO)2的混合物,胆矾是CuSO4?5H2O,HD即氢气;
C、碱是电离出的阴离子全部是氢氧根的化合物;酸即电离出的阳离子全部是氢离子的化合物;小苏打即NaHCO3;
D、强电解质是指在水溶液中能完全电离的化合物;弱电解质是指在水溶液中不能全部电离的化合物.
解答:
解:A、酸性氧化物是能和碱反应生成盐和水的氧化物,CO不是酸性氧化物,是不成盐氧化物;碱性氧化物是指能和酸生成盐和水的氧化物,Na2O2与酸反应时除了生成盐和水,还生成氧气,故不是碱性氧化物,故A错误;
B、漂白粉是CaCl2和Ca(ClO)2的混合物,胆矾是CuSO4?5H2O,是纯净物,HD即氢气,故是单质,故B正确;
C、纯碱是Na2CO3,是盐不是碱,硫化氢是酸,小苏打即NaHCO3,是酸式盐,故C错误;
D、盐酸是HCl的水溶液,是混合物,不是电解质;硫酸钡是强电解质,醋酸是弱电解质,故D错误;
故选B.
B、漂白粉是CaCl2和Ca(ClO)2的混合物,胆矾是CuSO4?5H2O,是纯净物,HD即氢气,故是单质,故B正确;
C、纯碱是Na2CO3,是盐不是碱,硫化氢是酸,小苏打即NaHCO3,是酸式盐,故C错误;
D、盐酸是HCl的水溶液,是混合物,不是电解质;硫酸钡是强电解质,醋酸是弱电解质,故D错误;
故选B.
点评:本题考查了酸碱和酸性氧化物、碱性氧化物和强弱电解质的辨析,根据定义来解题时关键,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
有机物甲是一种含有一个六元环结构的化合物,其分子式为C7H12O2,在酸性条件下可以发生水解,且水解产物只有一种,又知甲的分子中含有两个甲基,则甲的可能结构有( )
| A、6种 | B、8种 | C、10种 | D、9种 |
下列说法错误的是( )
| A、升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 |
| B、决定化学反应速率的主要因素是参加反应的物质的性质 |
| C、对于有气体参加的反应,增大压强,反应速度一定加快 |
| D、催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
下列各项中表达正确的是( )
A、F原子结构示意图: |
B、次氯酸电子式: |
| C、H、D、T表示同一种核素 |
D、CH4分子的球棍模型: |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )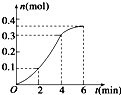

| A、反应在第2min到第4 min内生成CO2的平均反应速率为前2min的2倍 |
| B、反应开始4min内温度对反应速率的影响比浓度大 |
| C、反应速率先增大后减小 |
| D、反应开始2min内平均反应速率最大 |
物质的量相等的Na2CO3和 NaHCO3分别与足量的盐酸反应,得到CO2的物质的量之比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、1:3 |
1L(标准状况下)某烃,完全燃烧生成CO2和水蒸气在273℃,1.01×105 Pa下,混合气体体积为y L,当冷却至标准状况时气体体积为x L,下列用x、y表示该烃的化学式正确的是( )
| A、CxHy |
| B、CxHy -x |
| C、CxH2y-2x |
| D、CxHy-2x |
 用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积.下列选项中可正确表示实验X及Y的结果是( )
用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积.下列选项中可正确表示实验X及Y的结果是( )


