题目内容
11.光气(COCl2)是一种重要的有机中间体,化学性质不稳定,遇水迅速水解,工业上制备光气的原理为CO(g)+Cl2(g)?COCl2(g).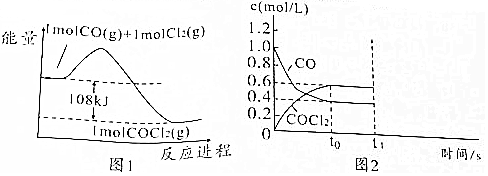
(1)光气分子中所有原子均满足稳定结构,其电子式为
 ;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;
;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;(2)上述反应过程的能量变化如图1所示,已知断裂1mol Cl-Cl、C-Cl、C=O分别需要吸收243kJ、328kJ和728kJ能量,则断裂0.5mol CO分子中的化学键需要吸收的能量为526.5kJ;
(3)某学习兴趣小组模拟工业制备光气的方法,在恒温恒容的容器中加入等物质的量的CO和Cl2(活性炭作催化剂),容器中有关物质的浓度变化如图2所示,已知0~t0时间段Cl2的平均反应速率为0.025mol/(L•s),则时间应为24s.
分析 (1)光气为COCl2,分子中所有原子均满足稳定结构,一根共价键含2个电子,据此写出电子式,光气遇水后生成两种气体,一种极易溶于水,为HCl,反应还产生CO2,据此写出反应的化学方程式;
(2)根据反应的能量变化图计算出反应的焓变△H,结合盖斯定律计算化学键的键能;
(3)在恒温恒容的容器中加入等物质的量的CO和Cl2(活性炭作催化剂),发生的反应为:CO(g)+Cl2(g)?COCl2(g),0~t0时间段Cl2的平均反应速率为0.025mol/(L•s),根据化学反应速率公式$\overline{r}=\frac{△c}{△t}$计算.
解答 解:(1)光气为COCl2,分子中所有原子均满足稳定结构,一根共价键含2个电子,则其电子式为: ,
,
光气遇水后生成两种气体,其中一种气体极易溶于水,为HCl,反应还产生CO2,则反应的化学方程式为:COCl2+H2O═2HCl+CO2,
故答案为: ;COCl2+H2O═2HCl+CO2;
;COCl2+H2O═2HCl+CO2;
(2)根据反应的能量变化图计算出反应的焓变△H=-108kJ/mol,根据盖斯定律,△H=反应物总键能-生成物总键能,则△H=E(C≡O)+E(Cl-Cl)-[E(C=O)+2E(C-Cl)]=-108kJ/mol,可得E(C≡O)=1053kJ/mol,则断裂0.5molCO分子中的化学键需要吸收的能量为$\frac{1053}{2}$=526.5kJ/mol,
故答案为:526.5;
(3)恒温恒容的容器中加入等物质的量的CO和Cl2(活性炭作催化剂),发生的反应为:CO(g)+Cl2(g)?COCl2(g),0~t0时间段Cl2的平均反应速率为0.025mol/(L•s),根据图象分析,COCl2在这段时间内的浓度改变量为△c=0.6mol/L,根据化学反应速率之比为化学计量数之比,则COCl2在这段时间内的化学反应平均速率为$\overline{r}$=0.025mol/(L•s),根据化学反应平均速率公式$\overline{r}=\frac{△c}{△t}$,则t0=$\frac{0.6mol/L}{0.025mol/(L•s)}$=24s,
故答案为:24.
点评 本题主要考察化学原理部分,包含电子式的书写,化学反应方程式的书写,可逆反应,化学平衡的移动,盖斯定律的应用,化学反应速率的计算,题目难度不大.

 习题精选系列答案
习题精选系列答案| A. | 蚕丝、人造丝充分水解后均可得到氨基酸 | |
| B. | 刚玉、红宝石主要成分都是氧化铝,陶瓷、分子筛、水晶主要成分都是硅酸盐 | |
| C. | 采取“静电除尘”方法净化空气,利用了胶体的相关知识 | |
| D. | 增塑剂DNOP(邻苯二甲酸二辛酯)因有特殊香味,也可用作食品添加剂 |
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”.
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为HCO3-、CO32-.
②在海洋碳循环中,可通过图1所示的途径固碳.写出钙化作用的离子方程式:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C.放电时,在正极得电子的物质为CO2;充电时,阳极的反应式为C-4e-+2CO32-═3CO2.
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气.图2表示恒压容器中0.5molCO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据B、D(填字母).
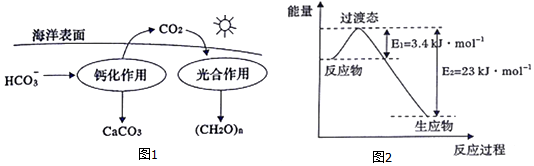
A.容器中压强不变 B.H2的体积分数不变
C.c(H2=3c(CH3OH) D.容器中密度不变
E.2个C=O断裂的同时有6个H-H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值<1 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正<v(逆)(填“<”、“>”或“=“).
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(I)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol.
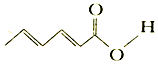
| A. | 分子式为C6H8O2 | |
| B. | 可使KMnO4(H+)溶液褪色 | |
| C. | 1 mol 该物质最多可与3 mol Br2 发生加成反应 | |
| D. | 可与醇发生取代反应 |
| A. | SO2、Cl2、H2S | B. | O2、H2、SO2 | C. | NO、H2、O2 | D. | CO、NH3、O2 |
| A. | Na2O | B. | Na2O2 | C. | NaHCO3 | D. | Na2CO3•10H2O |
| A. | 锌铁 | B. | 铁铝 | C. | 铁铜 | D. | 不能确定 |



