题目内容
12.在一定条件下,反应CO+NO2?CO2+NO△H=a kJ/mol达到平衡后,降低温度,混和气体的颜色变浅.下列判断正确的是( )| A. | a<0 | |
| B. | 使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| C. | 降低温度,CO的平衡转化率降低 | |
| D. | 降低温度,各物质的浓度不变 |
分析 反应CO+NO2?CO2+NO 中,只有NO2有颜色,降低温度导致混合气体的颜色变浅,说明二氧化氮气体浓度减小,平衡正向移动,正反应放热,据此分析.
解答 解:反应CO+NO2?CO2+NO 中,只有NO2有颜色,降低温度导致混合气体的颜色变浅,说明二氧化氮气体浓度减小,平衡正向移动,正反应放热,
A.正反应是放热反应,a<0,故A正确;
B.使用催化剂,只能影响化学反应速率,不能影响平衡,故B错误;
C.平衡正向移动,CO转化率增大,故C错误;
D.正反应是放热反应,降低温度,平衡移动,各种物质的浓度改变,故D错误;
故选A.
点评 本题考查了化学平衡的移动,注意混合气体颜色不变可以作为平衡状态的标志,题目难度不大.

练习册系列答案
相关题目
4.给定条件下,下列选项中所示的物质间转化能一步实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | B. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | ||
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{20}}{→}$H2SO4 |
5.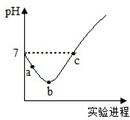 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| C. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| D. | 由a点到b点的过程中,溶液中$\frac{c(Cl{O}^{-})}{c({H}^{+})}$增大 |
2.在实验室中不宜用硫酸制备( )
| A. | 氢气 | B. | 二氧化碳 | C. | 氯化氢 | D. | 硫化氢 |
7.下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
⑤分子式为C3H6与C6H12的两种有机物一定互为同系物
⑥互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数)
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
⑤分子式为C3H6与C6H12的两种有机物一定互为同系物
⑥互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数)
| A. | 只有①②③④ | B. | 只有①②③④⑤ | C. | 只有②③④ | D. | 只有①②③ |
17.CO(g)+Cl2(g)?COCl2(g)△H<0.当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④加压;⑤加催化剂;⑥恒压通入惰性气体.能使CO体积分数增大的是( )
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ①③⑥ |
4. 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
(1)仅依据K的变化可推断出随着卤素原子核电荷数的增加cd(填字母)
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
1.当不慎有大量Cl2逸到周围空气里时,可用浸有一定浓度的下列物质溶液的毛巾捂住鼻子,该物质是( )
| A. | NaOH | B. | NaCl | C. | NH3•H2O | D. | NaHCO3 |
2.已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
| A. | 2W-+Z2=2Z-+W2 | B. | 2X-+Z2=2Z-+X2 | C. | 2X-+Y2=2Y-+X2 | D. | 2Z-+X2=2X-+Z2 |