��Ŀ����
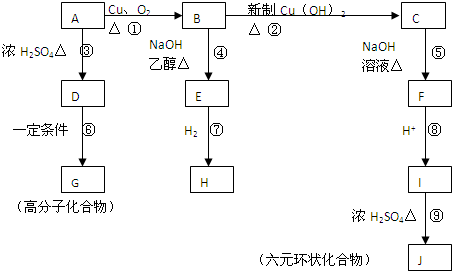
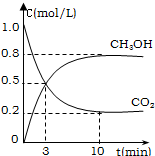 Ϊ��СCO2�Ի�����Ӱ�죬�������ŷ����� ͬʱ��Ӧ��ǿ��CO2�������õ��о�������CO2���ʵ������ºϳɼ״���ˮ����2L���ܱ������У�����2mol CO2��6mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ/mol�����CO2��g����CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
Ϊ��СCO2�Ի�����Ӱ�죬�������ŷ����� ͬʱ��Ӧ��ǿ��CO2�������õ��о�������CO2���ʵ������ºϳɼ״���ˮ����2L���ܱ������У�����2mol CO2��6mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ/mol�����CO2��g����CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ����1���ӷ�Ӧ��ʼ��ƽ�⣬v��H2��=
��2��������˵���ÿ��淴Ӧ�Ѵﵽ��ѧƽ��״̬����
A��CO2��CH3OH��Ũ�����
B�����������ܶȲ��ٷ����仯
C.3V����H2��=V�棨CH3OH��
D�������������ƽ�������������ٷ����仯
��3����ʹƽ����ϵ��n��CH3OH������Ĵ�ʩ��
��4��������ͬ�������£�ͬһ�����г���2molCH3OH��2mol H2O��g�����ﵽ��ѧƽ��״̬ʱn��CO2��=
���㣺��ѧƽ��ļ���,��ѧƽ���Ӱ������,��ѧƽ��״̬���ж�
ר�⣺��ѧƽ��ר��
��������1����Ӧ����=
����õ��״���Ӧ���ʣ�����֮�ȵ��ڻ�ѧ����ʽ������֮�ȵõ�������Ӧ���ʣ�
��2����Ӧ�ﵽƽ��״̬�ı�־�����淴Ӧ������ͬ������ֺ������ֲ��估�������ĸ��ֹ�ϵ�����жϣ�
��3����ʹƽ����ϵ��n��CH3OH������Ĵ�ʩ�Ǹı�����ƽ��������У��ı����ʹƽ��������Ӧ�ƶ�����������CH3OH�����ʵ������ݴ˽�Ϸ���ʽ�������
��4��������ͬ�������£�ͬһ�����г���2molCH3OH��2mol H2O��g�����ﵽ�����2mol CO2��6mol H2�ﵽ��ͬ�Ļ�ѧƽ��״̬�������㣻
| ��c |
| ��t |
��2����Ӧ�ﵽƽ��״̬�ı�־�����淴Ӧ������ͬ������ֺ������ֲ��估�������ĸ��ֹ�ϵ�����жϣ�
��3����ʹƽ����ϵ��n��CH3OH������Ĵ�ʩ�Ǹı�����ƽ��������У��ı����ʹƽ��������Ӧ�ƶ�����������CH3OH�����ʵ������ݴ˽�Ϸ���ʽ�������
��4��������ͬ�������£�ͬһ�����г���2molCH3OH��2mol H2O��g�����ﵽ�����2mol CO2��6mol H2�ﵽ��ͬ�Ļ�ѧƽ��״̬�������㣻
���
�⣺��1���ӷ�Ӧ��ʼ��ƽ�⣬V��CH3OH��=
=0.08mol/L?min��v��H2��=3V��CH3OH��=0.08mol/L?min��3=0.24mol/L?min��
�ʴ�Ϊ��0.24mol/��L��min����
��2��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ/mol����Ӧ�����������С�ķ��ȷ�Ӧ
A��CO2��CH3OH��Ũ����Ⱥ���ʼ�� �ͱ仯���йأ�����˵����Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ�������������䣬������䣬��Ӧ�����л��������ܶ�ʼ�ղ��ٷ����仯������˵����Ӧ�ﵽƽ��״̬����B����
C������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ�ڷ�Ӧ���ʣ���V����H2��=3V�棨CH3OH��ʱ��Ӧ�ﵽƽ��״̬����C����
D����Ӧǰ�������������䣬���ʵ�����С�������������ƽ�������������ٷ����仯��˵���������ʵ������䣬��Ӧ�ﵽƽ��״̬����D��ȷ
�ʴ�Ϊ��D��
��3����Ӧ����Ӧ�������С�ķ��ȷ�Ӧ���ʽ����¶Ȼ��ѹ������H2�����ȣ�����ʹƽ��������Ӧ�ƶ�������CH3OH�����ʵ�����
�ʴ�Ϊ�����ӷ�Ӧ���������£�
��4��������ͬ�������£�ͬһ�����г���2molCH3OH��2mol H2O��g�����ﵽ�����2mol CO2��6mol H2�ﵽ��ͬ�Ļ�ѧƽ��״̬��n��CO2��=0.2mol/L��2L=0.4mol��CH3OH��ת����=
��100%=20%
�ʴ�Ϊ��0.4mol��20%
| 0.8mol/L |
| 10min |
�ʴ�Ϊ��0.24mol/��L��min����
��2��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ/mol����Ӧ�����������С�ķ��ȷ�Ӧ
A��CO2��CH3OH��Ũ����Ⱥ���ʼ�� �ͱ仯���йأ�����˵����Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ�������������䣬������䣬��Ӧ�����л��������ܶ�ʼ�ղ��ٷ����仯������˵����Ӧ�ﵽƽ��״̬����B����
C������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ�ڷ�Ӧ���ʣ���V����H2��=3V�棨CH3OH��ʱ��Ӧ�ﵽƽ��״̬����C����
D����Ӧǰ�������������䣬���ʵ�����С�������������ƽ�������������ٷ����仯��˵���������ʵ������䣬��Ӧ�ﵽƽ��״̬����D��ȷ
�ʴ�Ϊ��D��
��3����Ӧ����Ӧ�������С�ķ��ȷ�Ӧ���ʽ����¶Ȼ��ѹ������H2�����ȣ�����ʹƽ��������Ӧ�ƶ�������CH3OH�����ʵ�����
�ʴ�Ϊ�����ӷ�Ӧ���������£�
��4��������ͬ�������£�ͬһ�����г���2molCH3OH��2mol H2O��g�����ﵽ�����2mol CO2��6mol H2�ﵽ��ͬ�Ļ�ѧƽ��״̬��n��CO2��=0.2mol/L��2L=0.4mol��CH3OH��ת����=
| 2mol-0.8mol/L��2L |
| 2mol |
�ʴ�Ϊ��0.4mol��20%
�����������漰��Ӧ���ʼ��㡢��ѧƽ��Ӱ����������㡢ƽ��״̬�жϣ���Ӧ���ʸ���ļ�������ȣ��Ƕ�֪ʶ���ۺ����ã��Ѷ��е�

��ϰ��ϵ�д�
 �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
�����Ŀ
���л������У�����ͨ�����ʼ�ֱ�ӻ��϶����ɵ��ǣ�������
| A��HCl |
| B��Na2O |
| C��FeCl2 |
| D��Fe3O4 |
ij������ϩ���Ļ��������ܶ���1.07g?L-1����״��������������ϩ�����������4��1�����������ǣ�������
| A��CH4��C2H4 |
| B��C2H6��C2H4 |
| C��CH4��C4H8 |
| D��CH4��C3H6 |
���и������������ʵ�����Ϊa mol����ÿ���������������ʵ���֮�Ȼ����ȫȼ��ʱ������O2����������ǣ�������
| A�����顢�״� |
| B����ϩ�������� |
| C����Ȳ���� |
| D���Ҵ�����ϩ�� |