题目内容
有A、B、C、D、E五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍.请回答下列问题:
(1)写出由A、C、D三种元素形成的化合物的电子式 ,该化合物的化学键类型为 .
(2)D2E溶液呈 (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 .
(3)0.5L 0.1mol?L-1D的最高价氧化物的水化物与0.25L 0.1mol?L-1E的最高价氧化物的水化物反应放出2865J的热量,该反应的热化学方程式为: .
(4)由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质.则其负极电极反应方程式 .
(1)写出由A、C、D三种元素形成的化合物的电子式
(2)D2E溶液呈
(3)0.5L 0.1mol?L-1D的最高价氧化物的水化物与0.25L 0.1mol?L-1E的最高价氧化物的水化物反应放出2865J的热量,该反应的热化学方程式为:
(4)由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质.则其负极电极反应方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,则C为氧元素,C和E同主族,则E为硫元素,B元素原子的最外层电子数比C元素原子的最外层电子数少1个,则B为氮元素;A和D同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍,则A为氢元素,D为钠元素,据此答题.
解答:
解:A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,则C为氧元素,C和E同主族,则E为硫元素,B元素原子的最外层电子数比C元素原子的最外层电子数少1个,则B为氮元素;A和D同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍,则A为氢元素,D为钠元素,
(1)由A、C、D三种元素形成的化合物为氢氧化钠,它的电子式为 ,氢氧化钠的化学键类型为离子键、极性共价键,
,氢氧化钠的化学键类型为离子键、极性共价键,
故答案为: ;离子键、极性共价键;
;离子键、极性共价键;
(2)NaS2溶液呈碱性,因为硫离子水解产生氢氧根离子,离子方程式为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,
故答案为:碱性;S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(3)E的最高价氧化物的水化物为硫酸,D的最高价氧化物为氢氧化钠,0.5L 0.1mol/LNaOH(aq)与0.25L 0.1mol/LH2SO4(aq)反应,两者恰好完全反应,放出2865J热量,则1molNaOH完全反应放出57.3KJ的热量,所以其热化学方程式为NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(1)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(1)△H=-57.3kJ/mol;
(4)由氨气与氧气、KOH溶液构成原电池,负极产生是氨气被氧化成氮气,其负极电极反应方程式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
(1)由A、C、D三种元素形成的化合物为氢氧化钠,它的电子式为
 ,氢氧化钠的化学键类型为离子键、极性共价键,
,氢氧化钠的化学键类型为离子键、极性共价键,故答案为:
 ;离子键、极性共价键;
;离子键、极性共价键;(2)NaS2溶液呈碱性,因为硫离子水解产生氢氧根离子,离子方程式为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,
故答案为:碱性;S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(3)E的最高价氧化物的水化物为硫酸,D的最高价氧化物为氢氧化钠,0.5L 0.1mol/LNaOH(aq)与0.25L 0.1mol/LH2SO4(aq)反应,两者恰好完全反应,放出2865J热量,则1molNaOH完全反应放出57.3KJ的热量,所以其热化学方程式为NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
(4)由氨气与氧气、KOH溶液构成原电池,负极产生是氨气被氧化成氮气,其负极电极反应方程式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
点评:本题主要考查了电子式、盐类的水解、热化学方程式、原电池电极反应等知识,中等难度,元素推断是解题的关键,答题时注意审题,正确使用题中信息.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
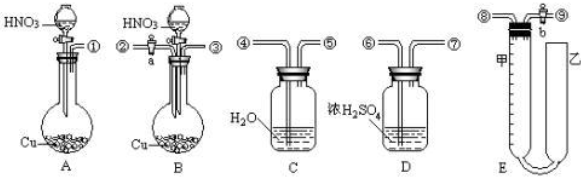
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- |
| B、常温下的溶液:KW/c(H+)=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
| C、稀硫酸中:K+、Mg2+、AlO2-、S2O32- |
| D、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
近年来,华北多个地区发生持续雾霾天气,“PM2.5”数据监测纳入公众视野.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物.下列有关说法中,错误的是( )
| A、雾属于胶体,能产生丁达尔现象 |
| B、目前的雾霾污染,无需治理借助于天气状况改善即可 |
| C、PM2.5颗粒含有重金属、多种烃等有毒物质 |
| D、汽车尾气是目前城市大气污染气体和细小颗粒物产生的一个重要来源 |
如图所示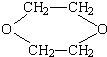 是一种常见的溶剂,是它可以通过下列路线制得:
是一种常见的溶剂,是它可以通过下列路线制得:
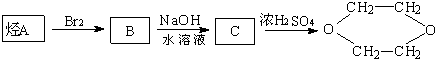
则A可能是( )
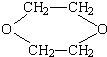 是一种常见的溶剂,是它可以通过下列路线制得:
是一种常见的溶剂,是它可以通过下列路线制得:
则A可能是( )
| A、乙烯 | B、乙醇 | C、乙二醇 | D、乙醚 |
下列化工生产过程中所发生的反应不属于氧化还原反应的是( )
| A、用氯气和消石灰制漂白粉 |
| B、用氢气和氮气合成氨 |
| C、用铁矿石炼铁 |
| D、用石灰石生产生石灰 |
据《自然》杂志网站2013年1月3日报道,德国物理学家用钾原子首次造出一种低于绝对零度的量子气体.科学家称这一成果为“实验的绝技”,为将来造出负温度物质、新型量子设备打开了大门,有助于揭开宇宙中的许多奥密.钾的化合物在科技、生活生产中应用广泛,则下列叙述正确的是( )
| A、超氧化钾(KO2)可作为飞船、潜艇等密闭系统的氧气再生剂,若有1molKO2被消耗,可产生O2 22.4L |
| B、高锰酸钾溶液是实验室常用的试剂,欲配置1.00L 0.10mol/L的KMnO4溶液,可将15.8g KMnO4溶于1L水中 |
| C、KNO3可用于制造黑火药,已知黑火药反应为S+2KNO3+3C=K2S+N2↑+3CO2↑,若有1mol KNO3被消耗,则该反应转移电子5×6.02×1023 |
| D、氰化钾(KCN、剧毒)可用于电镀,使镀层更细致,65g KCN晶体中,离子总数为2×6.02×1023 |
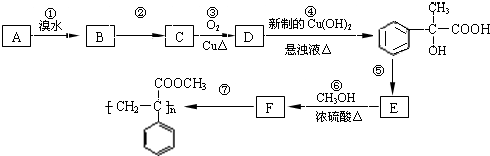
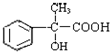 有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式:
有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式: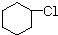 为原料合成
为原料合成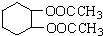
 )
)