题目内容
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)写出各元素的符号:A ;B ;C ;D ;E ;F .
(2)写出B与C形成的化合物的电子式 .
(3)请写出基态原子F的简化电子排布式 .
(4)上述六种元素按电负性从小到大的排列是 (写元素符号).
(5)C、D、E、F元素第一电离能从小到大的排列是 (写元素符号);
(6)A、B、C、D四种元素的简单离子按半径由小到大的顺序为(用离子符号表示) .
(7)C、D、E、F四种元素中,形成的最高价氧化物对应水化物中(写化学式):酸性最强的是 碱性最强的是 .呈两性的是 .
(1)写出各元素的符号:A
(2)写出B与C形成的化合物的电子式
(3)请写出基态原子F的简化电子排布式
(4)上述六种元素按电负性从小到大的排列是
(5)C、D、E、F元素第一电离能从小到大的排列是
(6)A、B、C、D四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)
(7)C、D、E、F四种元素中,形成的最高价氧化物对应水化物中(写化学式):酸性最强的是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,据此答题.
解答:
解:原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,
(1)由上面的分析可知,A为O;B为F;C为Mg;D为Al;E为P;F为S,
故答案为:O;F;Mg;Al;P;S;
(2)写B与C形成的化合物为氟化镁,它的电子式为 ,
,
故答案为: ;
;
(3)F为硫,它的简化电子排布式为:[Ne]3s23p4,
故答案为:[Ne]3s23p4;
(4)根据元素周期律,同周期元素从左向右电负性增大,同主族元素从上向下,电负性减弱,所以六种元素按电负性从小到大的排列是Mg<Al<P<S<O<F,故答案为:Mg<Al<P<S<O<F;
(5)Mg、Al、P、S元素第一电离取决于金属性的强弱,金属性越强,第一电离能越小,但是由于铝核外本来是3s23p1,失去一个电子后,核外电子变成 3s2 这是一种稳定的结构,所以铝失去第一个电子比镁要容易,
故答案为:Al<Mg<S<P;
(6)O、F、Mg、Al四种元素的简单离子,最外层电子排布相同,由于原子序数越小,对外层电子的吸引能力越弱,故原子序数越小,半径越大,故按半径由小到大的顺序为:Al3+<Mg2+<F-<O2-,
故答案为:Al3+<Mg2+<F-<O2-;
(7)元素的金属性越强,元素的最高价氧化物对应水化物的碱性越强,元素的非金属性越强,元素的最高价氧化物对应水化物的酸性越强,所以在C、D、E、F四种元素中,形成的最高价氧化物对应水化物中,酸性最强的是H2SO4,碱性最强的是 Mg(OH)2,呈两性的是Al(OH)3,
故答案为:H2SO4;Mg(OH)2;Al(OH)3;
(1)由上面的分析可知,A为O;B为F;C为Mg;D为Al;E为P;F为S,
故答案为:O;F;Mg;Al;P;S;
(2)写B与C形成的化合物为氟化镁,它的电子式为
 ,
,故答案为:
 ;
;(3)F为硫,它的简化电子排布式为:[Ne]3s23p4,
故答案为:[Ne]3s23p4;
(4)根据元素周期律,同周期元素从左向右电负性增大,同主族元素从上向下,电负性减弱,所以六种元素按电负性从小到大的排列是Mg<Al<P<S<O<F,故答案为:Mg<Al<P<S<O<F;
(5)Mg、Al、P、S元素第一电离取决于金属性的强弱,金属性越强,第一电离能越小,但是由于铝核外本来是3s23p1,失去一个电子后,核外电子变成 3s2 这是一种稳定的结构,所以铝失去第一个电子比镁要容易,
故答案为:Al<Mg<S<P;
(6)O、F、Mg、Al四种元素的简单离子,最外层电子排布相同,由于原子序数越小,对外层电子的吸引能力越弱,故原子序数越小,半径越大,故按半径由小到大的顺序为:Al3+<Mg2+<F-<O2-,
故答案为:Al3+<Mg2+<F-<O2-;
(7)元素的金属性越强,元素的最高价氧化物对应水化物的碱性越强,元素的非金属性越强,元素的最高价氧化物对应水化物的酸性越强,所以在C、D、E、F四种元素中,形成的最高价氧化物对应水化物中,酸性最强的是H2SO4,碱性最强的是 Mg(OH)2,呈两性的是Al(OH)3,
故答案为:H2SO4;Mg(OH)2;Al(OH)3;
点评:本题主要考查了电子式、电子排布式、元素周期律等知识点,中等难度,元素推断是解题的关键,答题时注意元素周期律的灵活运用.

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、铁和稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸钙溶于稀盐酸中 CO32-+2H+=CO2↑+H2O |
| C、碳酸氢钠溶液与盐酸反应 HCO3-+H+=CO2↑+H2O |
| D、氧化铜与盐酸反应 O2-+2H+=H2O |
下列有关物质的表达式正确的是( )
| A、乙酸乙酯的结构简式:CH3CH2COOCH3 |
B、2-甲基-2-戊烯的键线式: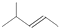 |
| C、乙醇的结构简式:CH3CH2OH |
| D、1,3-丁二烯的分子式:C4H8 |
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
| A、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ?mol-1 | ||
B、C2H2(g)+
| ||
| C、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ?mol-1 | ||
| D、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ?mol-1 |
 ,
,
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.回答下列问题: