题目内容
1.下列说法合理的是( )| A. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液,则离子方程式为:HA-+OH-=A2-+H2O | |
| B. | 室温时,1.0L、pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3•H2O+Al(OH)3↓+2BaSO4↓ |
分析 A.0.1mol/L、pH=1的NaHA溶液,可知为强酸的酸式盐,完全电离;
B.1.0L、pH=13的Ba(OH)2溶液中含有OH-为1L×0.1mol/L=0.1mol;
C.由水电离出的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液;
D.使SO42-完全沉淀,以1:2反应,生成硫酸钡、氢氧化铝和一水合氨.
解答 解:A.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液,则离子方程式为H++OH-=H2O,故A错误;
B.1.0L、pH=13的Ba(OH)2溶液中含有OH-为1L×0.1mol/L=0.1mol,含有OH-的数目为0.1NA,故B错误;
C..由水电离出的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液,酸溶液中I-、NO3-发生氧化还原反应,碱溶液中不能大量存在Mg2+,故C错误;
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-=NH3•H2O+Al(OH)3↓+2BaSO4↓,故D正确;
故选D.
点评 本题考查离子反应方程式的书写及离子共存,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
12.下列反应中,不属于氧化还原反应的是( )
| A. | Cl2+H2$\frac{\underline{\;光\;}}{\;}$2HCl | B. | 2FeCl3+Cu═2FeCl2+CuCl2 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
16.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
| B | 向无色溶液中加硝酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中一定含SO42- |
| C | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2CO3的酸性比H2SiO3强 |
| D | 向某溶液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
6.已知某可逆反应,x A(g)?y B(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,测得A的浓度为0.3mol/L.下列判断正确的是( )
| A. | x<y | |
| B. | 平衡向正反应方向进行 | |
| C. | B的体积分数降低 | |
| D. | 缩小体积、增大压强,A的体积分数增大 |
13.除去下列括号内的杂质,所用试剂正确的是( )
| 选项 | 需除杂的物质 | 试剂 |
| A | Fe(Al) | NaOH溶液 |
| B | CO2(HCl) | NaOH溶液 |
| C | NaCl(Na2CO3) | 稀硫酸 |
| D | NH3(H2O) | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关化学实验叙述正确的是( )
| A. | 容量瓶、分液漏斗使用前都必须检查是否漏水 | |
| B. | 用98%的浓硫酸配制100 g 10%的稀硫酸时,除使用量筒外还需用到容量瓶 | |
| C. | 在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中 | |
| D. | 配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度偏低 |
11.下列各组离子能在溶液中大量共存的是( )
| A. | Na+、OH-、HS-NO3- | B. | Al3+、Cl-、HCO3-、Na+ | ||
| C. | AlO2-、K+、CO32-、Na+ | D. | Fe2+、K+、H+、NO3- |
 如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是右瓶的现象是有色布条褪色,而右瓶不褪色.
如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是右瓶的现象是有色布条褪色,而右瓶不褪色.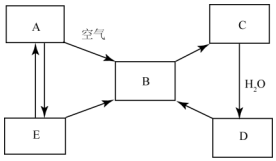 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B气体具有漂白性,可用于漂白纸张、草编织品等,且B和C的相对分子质量之比为4:5,化合物D是重要的工业原料,E是具有臭鸡蛋气味的气体.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B气体具有漂白性,可用于漂白纸张、草编织品等,且B和C的相对分子质量之比为4:5,化合物D是重要的工业原料,E是具有臭鸡蛋气味的气体.