题目内容
6.下列各组物质的熔沸点能用化学键的强弱解释的是( )| A. | H2O>H2S | B. | NaCl>O2 | C. | Na>K | D. | SiO2>CO2 |
分析 A.水分子之间含氢键,沸点高;
B.NaCl为离子晶体,氧气为分子晶体;
C.Na、K均为金属晶体,K的离子半径大、金属键弱;
D.SiO2为原子晶体,CO2为分子晶体.
解答 解:A.水分子之间含氢键,沸点高,则熔沸点H2O>H2S,与氢键、分子间作用力有关,故A不选;
B.NaCl为离子晶体,氧气为分子晶体,与晶体类型有关,故B不选;
C.Na、K均为金属晶体,K的离子半径大、金属键弱,则熔沸点能用化学键的强弱解释,故C选;
D.二者均含共价键,SiO2为原子晶体,CO2为分子晶体,与晶体类型、空间结构有关,故D不选;
故选C.
点评 本题考查物质的性质及化学键,为高频考点,把握晶体类型、作用力与性质的关系为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
14.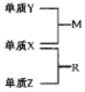 X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
 X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为1:1的化合物 | |
| C. | X、Y、Z元素形成的单质均具有强还原性 | |
| D. | R的沸点高于M的沸点 |
1.下列元素非金属性最强的是( )
| A. | 硅 | B. | 磷 | C. | 硫 | D. | 砷 |
18.分子式为CnH2n+1Cl( n>l)的卤代烃不能发生消去反应,n的最小值是( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
15.用下列装置进行的实验,能达到相应实验目的是( )
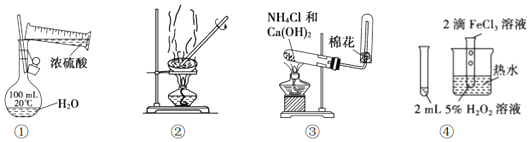

| A. | 用装置①配制一定浓度的硫酸溶液 | |
| B. | 用装置②分离溶解在CCl4中的 I2 | |
| C. | 用装置③制备和收集少量 NH3 | |
| D. | 用装置④验证FeCl3对 H2O2分解有催化作用 |
 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
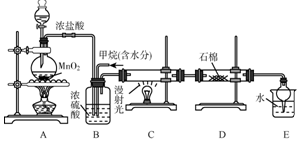 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图: 铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.
铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.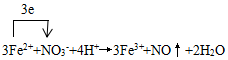 ;
;