题目内容
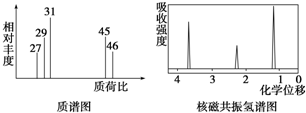
5.某有机物的核磁共振氢谱图中有三个吸收峰,且面积之比为1:2:3,质谱图表明该有机物的相对分子质量为70,红外光谱表征到该有机物中有C=C和C=O的存在.下列说法正确的是( )| A. | 该物质的分子式为C3H8O | |
| B. | 分子中共有6种化学环境不同的氢原子 | |
| C. | 该有机物的结构简式为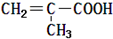 | |
| D. | 该有机物可能与新制的氢氧化铜反应 |
分析 红外光谱表征到C═C和C═O的存在,相对分子质量为70,含有1个C═C和1个C═O,去掉1个C═C和1个C═O的式量后剩余式量为70-36-16=18,应含有1个C原子、6个H原子,故该有机物分子式为C4H6O,有机物的核磁共振氢谱图中有三个吸收峰,说明含有3种H原子,且面积之比为1:2:3,结构简式应为CH2=C(CH3)CH0,以此解答该题.
解答 解:红外光谱表征到C═C和C═O的存在,相对分子质量为70,含有1个C═C和1个C═O,去掉1个C═C和1个C═O的式量后剩余式量为70-36-16=18,应含有1个C原子、6个H原子,故该有机物分子式为C4H6O,有机物的核磁共振氢谱图中有三个吸收峰,说明含有3种H原子,且面积之比为1:2:3,结构简式应为CH2=C(CH3)CH0,
A.该有机物分子式为C4H6O,故A错误;
B.分子中共有3种化学环境不同的氢原子,故B错误;
C.结构简式应为CH2=C(CH3)CH0,故C错误;
D.含有醛基,可与新制的氢氧化铜反应,故D正确.
故选D.
点评 本题考查有机物结构的推断、核磁共振氢谱、红外光谱等,为高频考点,侧重考查学生分析推理能力,注意利用残余法进行分子式确定,难度中等.

练习册系列答案
相关题目
13.电子构型为[Ar]3d54s2的元素是( )
| A. | 稀有气体 | B. | 金属元素 | C. | 主族元素 | D. | 非金属元素 |
14.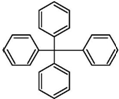 甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
 甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子不可能共平面 | |
| C. | 该物质光照下可和氯气发生反应 | |
| D. | 该物质在Fe粉催化下可和液溴发生反应 |
11.下列含有兴奋剂成分的药物是 ( )
| A. | 阿司匹林 | B. | 青霉素 | C. | 抗酸药 | D. | 麻黄碱 |
17.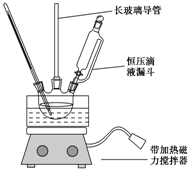 硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
①取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入恒压滴液漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④分离出产物后,依次用蒸馏水和100mL 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
⑤向粗产品加入固体D除去水,然后蒸馏,得到纯净的硝基苯.
可能用到的有关数据列表如下
(1)写出该反应的化学方程式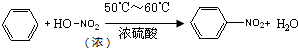 .
.
(2)配制混酸应在烧杯中先加入浓硝酸,长玻璃管作用是冷凝回流,恒压滴液漏斗的优点是使混合酸能顺利流下.
(3)反应温度控制在50~60℃的原因是防止副反应发生,反应结束后产物在下层(填“上”或者“下”),分离混酸和产品的操作名称是分液.
(4)实验前要配制100mL 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器除了玻璃棒、烧杯还有100ml容量瓶、胶头滴管.
(5)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)固体D的名称为无水氯化钙.
 硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:①取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入恒压滴液漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④分离出产物后,依次用蒸馏水和100mL 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
⑤向粗产品加入固体D除去水,然后蒸馏,得到纯净的硝基苯.
可能用到的有关数据列表如下
| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
 .
.(2)配制混酸应在烧杯中先加入浓硝酸,长玻璃管作用是冷凝回流,恒压滴液漏斗的优点是使混合酸能顺利流下.
(3)反应温度控制在50~60℃的原因是防止副反应发生,反应结束后产物在下层(填“上”或者“下”),分离混酸和产品的操作名称是分液.
(4)实验前要配制100mL 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器除了玻璃棒、烧杯还有100ml容量瓶、胶头滴管.
(5)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)固体D的名称为无水氯化钙.
14.用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4•H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是SiO2.
(2)将MnO2氧化Fe2+的离子方程式补充完整:
1MnO2+2Fe2++4H+=1 Mn2++2Fe3++2H2O
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-,使制得的MnSO4?H2O产品更纯净.
(4)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是4.7≤a<7.6.
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4-与Mn2+反应生成MnO2.取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为$\frac{1.5y×1{0}^{-4}×55}{x}$.
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是SiO2.
(2)将MnO2氧化Fe2+的离子方程式补充完整:
1MnO2+2Fe2++4H+=1 Mn2++2Fe3++2H2O
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-,使制得的MnSO4?H2O产品更纯净.
(4)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
步骤Ⅲ中a的取值范围是4.7≤a<7.6.
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4-与Mn2+反应生成MnO2.取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为$\frac{1.5y×1{0}^{-4}×55}{x}$.
15.下列有关说法正确的是( )
| A. | CH2═CH2与CH3CH2OH均可以使KMnO4(H+)褪色,且褪色原理相同 | |
| B. | 乙酸乙酯的制取中,水浴加热的目的有:加快化学反应速率,同时使产物分离,平衡正向移动 | |
| C. | 等质量的CH3CH2OH与CH3COOH,均能与足量的金属钠发生取代反应,前者反应速率较后者慢,且生成等物质量的H2 | |
| D. | 在一溴乙烷中加入NaOH和CH3CH2OH,加热,加入HNO3酸化的AgNO3,出现淡黄色沉淀,说明溴乙烷发生了水解反应 |
 如图是一个电化学过程示意图.
如图是一个电化学过程示意图.