题目内容
13. 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HC1溶液,测得溶液中某几种离子的物质的量变化如图所示,则下列说法不正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HC1溶液,测得溶液中某几种离子的物质的量变化如图所示,则下列说法不正确的是( )| A. | b和c曲线表示的离子反应均为CO32-+H+═HCO3- | |
| B. | 结合H+的能力:A1O2->CO32->HCO3->Al(OH)3 | |
| C. | M点时Al(OH)3的质量等于3.9 g | |
| D. | 原混合溶液中,CO32-与A1O2-的物质的量之比为2:1 |
分析 向Na2CO3、NaAlO2的混合溶液中逐滴加入150mL1mol•L-1的盐酸,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-减少,此阶段Al(OH)3不参与反应,据此结合选项解答.
解答 解:A.b曲线表示碳酸钠和盐酸反应,c曲线也表示碳酸钠和盐酸的反应,只是b曲线表示碳酸钠的物质的量,c曲线表示碳酸氢钠的物质的量,所以b和c曲线表示的离子反应是相同的,都是CO32-+H+═HCO3-,故A正确;
B、根据以上分析,氢离子先与A1O2-反应,再与CO32-反应,后与HCO3-反应,最后才溶解Al(OH)3,所以结合H+的能力:A1O2->CO32->HCO3->Al(OH)3,故B正确;
C、盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32+反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)0.05mol,m(Al(OH)3)=0.05mol×78g/mol=3.9g,故C正确;
D、由图象知,Na2CO3、NaAlO2的物质的量相等都是0.05mol,由此判断溶液中CO32-与AlO2-的物质的量之比为1:1,故D错误.
故选D.
点评 本题考查了反应与图象的关系,明确图象中各条曲线表示的物质是解本题的关键,结合H+的能力:AlO2-强于强于CO32-强于HCO3-强于Al(OH)3,难度较大.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 加聚反应 |
(1)简述检验Na2SO3已经变质的操作和现象:取少量样品于试管中,加水溶解,先加入过量盐酸,再加入氯化钡溶液,如果有白色沉淀生成,表明Na2SO3已经变质.
(2)另取10.0g试样配成250mL溶液,配制溶液时,可能用到的玻璃仪器有量筒、烧杯、玻璃棒、250 mL容量瓶、胶头滴管.取出25.00mL所配制的Na2SO3溶液于锥形瓶中,用标准酸性KMnO4溶液滴定,采用的指示剂是无(如果不需要,可写“无”).判断滴定实验达到终点的方法是当最后一滴酸性KMnO4溶液滴入锥形瓶后,瓶内溶液变成浅粉红色且半分钟内不褪色.反应的离子方程式为SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平).重复操作四次,消耗0.10mol•L-1 KMnO4溶液的体积如下:
| 编号溶液 | 1 | 2 | 3 | 4 |
| KMnO4(mL) | 20.01 | 19.00 | 19.99 | 20.00 |
| Na2SO3(mL) | 25.00 | 25.00 | 25.00 | 25.00 |
(3)操作时,若未用0.10mol•L-1的酸性KMnO4溶液润洗滴定管,会导致测定结果偏高(填“偏高”、“偏低”或“没有影响”).
①可用灼烧的方法鉴别蚕丝、羊毛织物
②用浓硝酸验证面筋的主要成分是蛋白质
③用饱和Na2CO3溶液除去乙酸乙酯中混有的少量乙酸、乙醇
④用溴水或酸性高锰酸钾溶液验证石蜡油裂化的产物中含有烯烃
⑤只用新制的Cu(OH)2 悬浊液试剂就可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液.
| A. | 只有①③④⑤ | B. | 只有①④⑤ | C. | 只有②③④⑤ | D. | 只有②③④ |
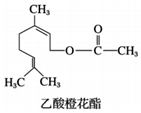 乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )①分子式为C12H19O2;
②不能发生银镜反应;
③1mol该有机物最多能与3mol氢气发生加成反应;
④它的同分异构体中不可能有酚类;
⑤1mol该有机物与NaOH溶液反应最多消耗1mol NaOH;
⑥属于芳香族化合物.
| A. | ②④⑤ | B. | ①④⑤ | C. | ②③⑥ | D. | ②③④ |
| A. | 原子半径:A>B>D>C | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D(n+1)->Cn->An+>B(n+1)+ | D. | 金属性:B>A,非金属性:D>C |
 )是一种定香剂,以芳香醇A为原料合成H的一种流程如下:
)是一种定香剂,以芳香醇A为原料合成H的一种流程如下:
 (R1、R表示氢原子或烃基)
(R1、R表示氢原子或烃基) ;E的官能团名称是碳碳双键、羧基.
;E的官能团名称是碳碳双键、羧基. .
. 、
、 .
. (其他试剂自选).
(其他试剂自选). 碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题:
碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题: )等.
)等. 是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.
是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.