题目内容
阿伏加德罗常数为NA,下列说法中正确的是( )
| A、足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数一定为2NA |
| B、14g分子式为CnH2n的烯烃中含有的C=C的数目,一定为NA/n |
| C、71g氯气通入足量水中,反应中转移的电子总数为NA |
| D、7.5gSiO2晶体中含有的硅氧键数为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、锌和浓硫酸反应开始生成二氧化硫气体,随浓度减小,稀硫酸和锌反应生成氢气,生成的气体体积不是标准状况分析;
B、依据n=
计算物质的量,结合烯烃结构计算碳碳双键;
C、依据n=
计算物质的量,结合氯气和水反应是可逆反应不能进行彻底分析;
D、依据n=
计算物质的量,结合二氧化硅结构计算硅氧键数;
B、依据n=
| m |
| M |
C、依据n=
| m |
| M |
D、依据n=
| m |
| M |
解答:
解:A、足量Zn与一定量的浓硫酸反应,产生22.4L气体时,锌和浓硫酸反应开始生成二氧化硫气体,随浓度减小,稀硫酸和锌反应生成氢气,但气体体积不是标准状况下,所以22.4L气体物质的量不是1mol,所以转移的电子数不是2NA,故A错误;
B、14g分子式为CnH2n的烯烃物质的量n=
=
mol,烯烃是分子中含有一个碳碳双键的链烃,所以含有的C=C的数目,一定为
,故B正确;
C、71g氯气物质的量为1mol,通入足量水中,氯气和水反应是可逆反应不能进行彻底,反应中转移的电子总数小于NA,故C错误;
D、7.5gSiO2晶体物质的量=
=0.125mol,1mol二氧化硅含有4mol硅氧键,所以0.125mol二氧化硅结构中含有的硅氧键数=0.125mol×4×NA=0.5NA,故D正确;
故选BD.
B、14g分子式为CnH2n的烯烃物质的量n=
| 14g |
| 14g/mol |
| 1 |
| n |
| NA |
| n |
C、71g氯气物质的量为1mol,通入足量水中,氯气和水反应是可逆反应不能进行彻底,反应中转移的电子总数小于NA,故C错误;
D、7.5gSiO2晶体物质的量=
| 7.5g |
| 60g/mol |
故选BD.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是微粒结构和数目的计算方法,注意一下氯气和水反应是可逆反应不能进行彻底,题目难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,且W、X、Y+、Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素).下列关于这些元素的叙述错误的是( )
| A、X和其他三种元素均可形成至少2种二元化合物 |
| B、W和X、Z两种元素分别形成的二元化合物中,均有直线形分子 |
| C、W、X和Y三种元素可以形成其水溶液呈碱性的化合物 |
| D、Z和其他三种元素形成的二元化合物,其水溶液均呈酸性 |
下列方程式属于水解反应方程式的是( )
| A、H2CO3?HCO3-+H+ |
| B、HCO3-+H2O?H3O++CO32- |
| C、HCO3-+OH-═H2O+CO32- |
| D、CO32-+H2O?HCO3-+OH- |
下列各表述与示意图一致的是( )
A、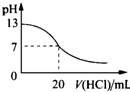 此图表示25℃时,用0.1mol/L盐酸滴定20mL 0.1mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 |
B、 此图表示一定条件下进行的反应2SO2(g)+O2(g)═2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 |
C、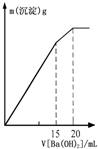 此图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 此图表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183kJ/mol |
已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
| A、Na2+、Ba2+、Br- |
| B、Na+、NH4+、SO32- |
| C、Mg2+、C1-、Fe2+ |
| D、A13+、Na+、C1- |
皮肤上若沾上少量的苯酚,正确的处理方法是( )
| A、冷水冲洗 |
| B、用70℃以上热水冲洗 |
| C、用酒精擦洗 |
| D、用稀NaOH溶液清洗 |
设阿伏加德罗常数为NA,下列叙述中正确的是( )
| A、常温常压下,32克氧气中原子个数为2NA |
| B、标准状况下,1mol H2O的体积为22.4L |
| C、常温常压下,1molH2的质量为2克 |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |