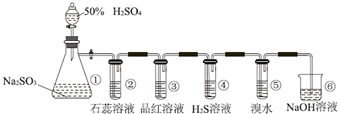
题目内容
9.下列离子方程式正确的是( )| A. | 铁和稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯气和溴化钠溶液反应:C12+2Br-→2C1-+Br2 | |
| C. | 氢氧化钡和稀硫酸反应:SO42-+Ba2+→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
分析 A.不符合反应客观事实;
B.二者反应生成氯化钠和溴;
C.漏掉氢离子与氢氧根离子;
D.醋酸为弱电解质,应保留化学式;
解答 解:A.铁和稀盐酸反应生成氯化亚铁和氢气,离子方程式:Fe+2H+=Fe2++H2↑,故A错误;
B.氯气和溴化钠溶液反应,离子方程式:C12+2Br-=2C1-+Br2,故B正确;
C.氢氧化钡和稀硫酸反应,离子方程式:2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,故C错误;
D.醋酸和碳酸钙反应,离子方程式:2CH3COOH+CaCO3=Ca2++CO2↑+H2O+2CH3COO-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式方法是解题关键,注意离子反应遵循客观事实、遵循电荷守恒、原子个数守恒,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法错误的是( )
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| C. | 对于有气体参加的反应,增大压强,反应速率加快 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
17.某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知:  | |
步骤: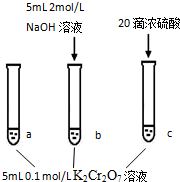 | 现象: 待试管b中颜色不变后与试管a比较,溶液颜色变浅. 滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深. |
| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
4.某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用.
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是SO2+H2O?H2SO3,H2SO3?HSO3-+H+.
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用,说明理由在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势、幅度接近,因此起氧化作用的主要是O2.
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
| 实验操作 | 实验现象 |
向2mL0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 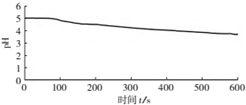 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 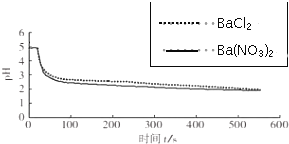 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用,说明理由在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势、幅度接近,因此起氧化作用的主要是O2.
14.能与Fe3+作用,且可证明Fe3+具有氧化性的微粒有( )
①SCN- ②Fe ③Fe2+ ④I- ⑤H2S ⑥OH-.
①SCN- ②Fe ③Fe2+ ④I- ⑤H2S ⑥OH-.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑥ | D. | ②④⑤ |
1.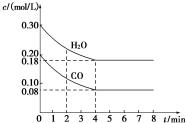 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
(1)0~4min CO的平均反应速率v(CO)=0.03mol/(L.min).
(2)达平衡时CO的转化率为60%,T1℃时该反应的平衡常数K=1.
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
①表中3~4min时,反应v正=v逆(填“>”、“<”或“=”); C1>0.08mol/L(填“>”、“<”或“=”).
②4~5min时,平衡向逆反应方向移动,可能的原因是d(填字母).
a.增加水蒸气 b.降低温度
c.增大了CO2浓度 d.增加了氢气浓度.
 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则(1)0~4min CO的平均反应速率v(CO)=0.03mol/(L.min).
(2)达平衡时CO的转化率为60%,T1℃时该反应的平衡常数K=1.
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | C4 |
②4~5min时,平衡向逆反应方向移动,可能的原因是d(填字母).
a.增加水蒸气 b.降低温度
c.增大了CO2浓度 d.增加了氢气浓度.
18.以乙烷燃料电池为电源进行电解的实验装置如图所示.下列说法正确的是( )
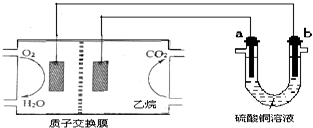

| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | a极是铜,b极是铁时,硫酸铜溶液浓度减小 | |
| C. | a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的7/2 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
7.某烃的结构简式为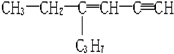 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )
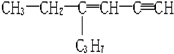 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )| A. | 5,6,4 | B. | 5,3,6 | C. | 5,4,8 | D. | 5,3,5 |