题目内容
5.请回答下列问题(1)H2SO4与HNO3的摩尔质量分别为98g/mol、63g/mol,9.8g H2SO4与6.3g HNO3所含的分子数相同,它们所含氢原子数之比是2:1.
(2)一定量H2SO4与HNO3中的氧原子数相等,则溶液中H2SO4与HNO3的物质的量之比为3:4.
分析 (1)摩尔质量以g/mol为单位,数值上等于其相对分子质量;依据n=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$结合硫酸为二氧酸、硝酸为一元酸解答;
(2)依据N=nNA,二者所含氧原子个数相等,则氧原子物质的量相等,结合1个硫酸分子含4个O,1个硝酸分子含有3个O解答.
解答 解:(1)摩尔质量以g/mol为单位,数值上等于其相对分子质量,硫酸的相对分子质量为98,所以摩尔质量为:98g/mol,硝酸的相对分子质量为63,所以摩尔质量为63g/mol;
要使硫酸与硝酸分子数相等,依据n=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$可知,二者物质的量相等,则:$\frac{9.8g}{98g/mol}$=0.1mol=$\frac{m}{63g/mol}$,解得硝酸的质量m=6.3g,0.1mol硫酸含有0.2mol氢原子,0.1mol硝酸含有0.1mol氢原子,所以二者所含氢原子数之比是2:1;
故答案为:98g/mol;63g/mol;6.3;2:1;
(2)1个硫酸分子含4个O,1个硝酸分子含有3个O,一定量H2SO4与HNO3中的氧原子数相等,则二者所含氧原子物质的量相等,需满足n(H2SO4)×4=n(HNO3)×3,解得:n(H2SO4):(HNO3)=3:4;
故答案为:3:4.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
15.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2 和盐酸; Cu(OH)2 和 CH3COOH | |
| B. | BaCl2 和 Na2SO4; Ba(OH)2 和 CuSO4 | |
| C. | NaHCO3 和 NaHSO4; Na2CO3 和 NaHSO4 | |
| D. | NaHCO3(过量) 和 Ca(OH)2; Ca(HCO3)2 和 NaOH(过量) |
16.下列说法正确的是( )
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 摩尔是七个基本物理量之一 | |
| C. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 | |
| D. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 |
10.25℃时,某一元酸(HB)对应的盐NaB的水溶液呈碱性,下列叙述正确的是( )
| A. | 0.1 mol/L NaB溶液中水电离的OH-浓度大于10-7 mol/L | |
| B. | NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-) | |
| C. | NaB溶液中:c(Na+)+c(H+)=c(HB)+c(B-) | |
| D. | HB的电离方程式为:HB═H++B- |
17. 在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )
在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )
 在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )
在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )| A. | 加催化剂 | B. | 降低温度 | C. | 增大NO的浓度 | D. | 缩小容器体积 |
14.下列有关氯气及其化合物的说法不正确的是( )
| A. | 氯气能与大多数金属化合,其一般将变价金属氧化至最高价 | |
| B. | 干燥的氯气和氯水均能使鲜花褪色 | |
| C. | 除去氯气中少量氯化氢可使气体通过饱和食盐水 | |
| D. | 因为氯气有毒,所以可用于杀菌、消毒、漂白 |
15.某混合气体中可能含有Cl2、O2、SO2、NO、NO2 中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )
| A. | 肯定有SO2 和NO | B. | 肯定有SO2和NO2 | ||
| C. | 可能有Cl2、NO和O2 | D. | 肯定有SO2、NO和O2 |
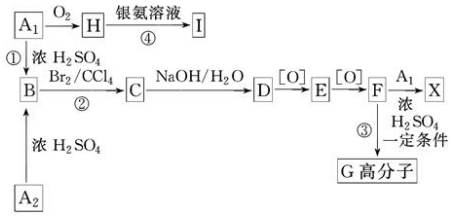
 .
. .
. .
. 、
、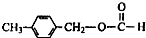
 、
、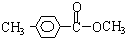 .
.