题目内容
已知:
①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA?H++A-,
其电离常数表达式 Ka=c(H+)?c (A-)/c (HA)(各浓度为平衡时浓度).该常数与浓度、压强无关,
只是温度的函数.25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol?L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如图:

请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 .
(2)25℃时,HF电离常数的数值Ka≈ ,列式并说明得出该常数的理由 .
(3)25℃时,4.0×10-3mol?L-1HF溶液与4.0×10-4 mol?L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA?H++A-,
其电离常数表达式 Ka=c(H+)?c (A-)/c (HA)(各浓度为平衡时浓度).该常数与浓度、压强无关,
只是温度的函数.25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol?L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如图:

请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(2)25℃时,HF电离常数的数值Ka≈
(3)25℃时,4.0×10-3mol?L-1HF溶液与4.0×10-4 mol?L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
考点:难溶电解质的溶解平衡及沉淀转化的本质,弱电解质在水溶液中的电离平衡
专题:
分析:(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀;
(2)根据电离平衡常数的表达式和图中离子浓度的关系来分析电离平衡常数的数值;
(3)根据溶液中离子的浓度来计算离子浓度幂之积,利用离子积与溶度积常数的关系来判断是否有沉淀生成.
(2)根据电离平衡常数的表达式和图中离子浓度的关系来分析电离平衡常数的数值;
(3)根据溶液中离子的浓度来计算离子浓度幂之积,利用离子积与溶度积常数的关系来判断是否有沉淀生成.
解答:
解:(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;
(2)由c(HF)、c(F-)与溶液pH的变化关系图可知,当c(F-)和c(HF)相等时,Ka(HF)=c(H+),在c(F-)和c(HF)相等时pH=3.45,再由Ka(HF)=
,pH即为Ka(HF)的负对数,则Ka(HF)≈10-3.45,
故答案为:10-3.45;Ka(HF)=
,当c(F-)和c(HF)相等时,Ka(HF)=c(H+),查图中的交点处即为c(F-)=c(HF),故所对应的pH即为Ka(HF)的负对数;
(3)查图可知当pH=4.0时,溶液中的c(F-)=1.6×10-3mol?L-1,因等体积混合则溶液中c(Ca2+)=2.0×10-4mol?L-1,即c(Ca2+)×c2(F-)=5.12×10-10>Ksp(CaF2))=1.5×10-10,所以有沉淀产生,
故答案为:pH=4.0时,则c(H+)=10-4,此时:根据HF电离产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4.c2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Ksp(CaF2)=1.5×10-10,此时有少量沉淀产生.
故答案为:Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;
(2)由c(HF)、c(F-)与溶液pH的变化关系图可知,当c(F-)和c(HF)相等时,Ka(HF)=c(H+),在c(F-)和c(HF)相等时pH=3.45,再由Ka(HF)=
| c(H +)?c(F -) |
| c(HF) |
故答案为:10-3.45;Ka(HF)=
| c(H +)?c(F -) |
| c(HF) |
(3)查图可知当pH=4.0时,溶液中的c(F-)=1.6×10-3mol?L-1,因等体积混合则溶液中c(Ca2+)=2.0×10-4mol?L-1,即c(Ca2+)×c2(F-)=5.12×10-10>Ksp(CaF2))=1.5×10-10,所以有沉淀产生,
故答案为:pH=4.0时,则c(H+)=10-4,此时:根据HF电离产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4.c2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Ksp(CaF2)=1.5×10-10,此时有少量沉淀产生.
点评:本题考查电离平衡常数与弱电解质的电离及利用溶度积来分析是否有沉淀生成,明确电离平衡常数的表达式和离子积的计算,并借助图来分析解答即可,较好的训练学生利用信息来分析问题、解决问题的能力.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
人类应以可持续发展的方式使用资源,以合理的方式对废物进行处理并循环使用,下列做法不利于环境保护的是( )
| A、回收并合理处理废电池 |
| B、将煤转化为水煤气作燃料 |
| C、发电厂的煤经脱硫处理 |
| D、电镀废液经中和后直接排放 |
将0.3mol硝酸银、0.6mol硝酸铜、0.7mol氯化钾溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.4mol铜,此时在另一极上产生的气体体积(标准状况)为多少( )
| A、4.48L | B、5.6L |
| C、6.72L | D、8.96L |
水的电离过程为H2O?H++OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14,Kw(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、c(H+)随着温度的升高而降低 |
| B、在35℃时,纯水中 c(H+)>c(OH-) |
| C、水的电离常数K(25℃)>K(35℃) |
| D、水的电离是一个吸热过程 |
有关煤的说法正确的是( )
| A、煤中含有单质碳、苯、二甲苯、焦炉气 |
| B、煤的干馏是物理变化 |
| C、煤由复杂的有机物和无机物组成,煤的干馏是化学变化 |
| D、煤主要含有碳和氢两种元素,同时还含有少量的硫、氧、氮等元素 |
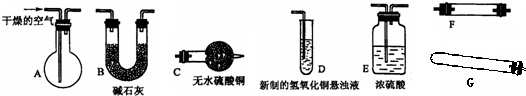

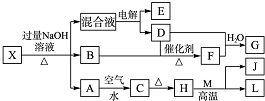 有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略).其中,B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热.
有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略).其中,B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热.