题目内容
11.在100mL混合溶液中,硝酸和硫酸的物质的量浓度分別是0.4mol•L-1、0.1mol•L-1,向混合溶液中加入1.92g铜粉,并加热,待充分反应后,所得溶液中Cu2+物质的量浓度是(假设反应前后溶液体积不变)( )| A. | 0.10mol•L-1 | B. | 0.15mol•L-1 | C. | 0.225mol•L-1 | D. | 0.30mol•L-1 |
分析 n(HNO3)=0.4mol/L×0.1L=0.04mol,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(H+)=n(HNO3)+2n(H2SO4)=0.04mol+0.02mol=0.06mol,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,Cu和硝酸反应离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据方程式知,假设0.03molCu完全反应需要氢离子0.08mol>0.06mol,所以Cu过量,以氢离子为标准计算生成铜离子的物质的量,据此分析解答.
解答 解:n(HNO3)=0.4mol/L×0.1L=0.04mol,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(H+)=n(HNO3)+2n(H2SO4)=0.04mol+0.02mol=0.06mol,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,Cu和硝酸反应离子方程式为 3Cu+2NO3-+8H+=3 Cu2++2NO↑+4H2O,根据方程式知,假设0.03molCu完全反应需要氢离子0.08mol>0.06mol,所以Cu过量,以氢离子为标准计算生成铜离子的物质的量,
0.06mol氢离子完全反应生成n(Cu2+)=$\frac{0.06mol}{8}×3$=0.0225mol,
c(Cu2+)=$\frac{0.0225mol}{0.1L}$=0.225mol•L-1,
故选C.
点评 本题混合物的有关计算,侧重考查分析计算能力,注意要先进行过量计算,然后根据量少的为标准进行计算,题目难度不大.

练习册系列答案
相关题目
1.现有物质的量浓度均为0.1mol/L的溶液①NH3•H2O②CH3COOH③KHSO4.下列有关离子浓度分析一定不正确的是( )
| A. | 向①中逐滴加入少量②,$\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$逐渐增大 | |
| B. | ①、③等体积混合后溶液中存在:NH4++H2O?NH3•H2O+H+ | |
| C. | ①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) | |
| D. | ①、③按体积比2:1混合:c(NH4+)>c(NH3•H2O)>c(SO42-)>c(OH-)>c(H+) |
2.已知:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
下列说法中,不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| n(CO) | n(H2O) | n(CO2) | n(H2) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
| ③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
| A. | 若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L•min) | |
| B. | 容器③中,开始时υ(CO)生成>υ(CO)消耗 | |
| C. | 达平衡过程体系能量的变化:Q1=4Q2 | |
| D. | 平衡时,①与②容器中CO的体积分数相等 |
19.在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?TCO2(g)+H2(g),有如下数据:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A. | 正反应为吸热反应 | |
| B. | 实验1中,CO的转化率为80% | |
| C. | 650℃时,化学平衡常数K=$\frac{8}{3}$ | |
| D. | 实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
16.(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5-8.6之间.某地海水中主要离子的含量如表:
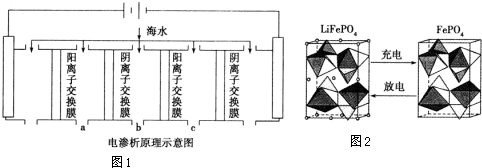
电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(2)锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(3)目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
①用K2FeO4处理中性废水时,K2FeO4与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的聚沉 作用.
②MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy 则可以判断x<y,氧化性:MFe2Oy< SO2(填“>”、“<”或“=”)
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(2)锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(3)目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
①用K2FeO4处理中性废水时,K2FeO4与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的聚沉 作用.
②MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy 则可以判断x<y,氧化性:MFe2Oy< SO2(填“>”、“<”或“=”)
3.随着社会的发展人们的生活越来越离不开化学.下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
20.下列家庭小实验能成功的是( )
| A. | 用淬火处理后的缝衣钢针制钓鱼钩 | B. | 用食盐水除去热水瓶中的水垢 | ||
| C. | 用电池“锌皮”与食醋反应制氢气 | D. | 用加热的方法修补电木插座 |
1.下列有关说法正确的是( )
| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).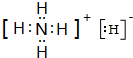 ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.