题目内容
19.在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?TCO2(g)+H2(g),有如下数据:| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A. | 正反应为吸热反应 | |
| B. | 实验1中,CO的转化率为80% | |
| C. | 650℃时,化学平衡常数K=$\frac{8}{3}$ | |
| D. | 实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
分析 A.利用三段式,计算出两个温度下的平衡常数,再根据平衡常数的大小可判断出该反应是放热反应还是吸热反应;
B.转化率=$\frac{转化的量}{起始量}×100%$;
C.根据根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
D.根据650℃时的平衡常数进行计算.
解答 解:A.在650℃时 CO(g )+H2O(g)?CO2(g)+H2(g),
起始(mol) 2.0 1.0 0 0
转化(mol) 0.8 0.8 0.8 0.8
平衡(mol) 1.2 0.2 0.8 0.8
平衡常数K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.8×0.8}{1.2×0.2}$=$\frac{8}{3}$,
在800℃时 CO(g )+H2O(g)?CO2(g)+H2(g),
起始(mol) 2.0 2.0 0 0
转化(mol) 1.0 1.0 1.0 1.0
平衡(mol) 1.0 1.0 1.0 1.0
平衡常数K=$\frac{1×1}{1×1}$=1,
由此可知在650℃时平衡常数大于800℃的平衡常数,即升高温度平衡逆向移动,故该反应的正反应为放热反应,故A错误;
B.在650℃时 CO(g )+H2O(g)?CO2(g)+H2(g),
起始(mol) 2.0 1.0 0 0
转化(mol) 0.8 0.8 0.8 0.8
平衡(mol) 1.2 0.2 0.8 0.8
CO的转化率=$\frac{0.8}{2}$×100%=40%,故B错误;
C.由A中的计算可知,650℃时,化学平衡常数K=$\frac{8}{3}$,故C正确;
D.设平衡时n(CO2)为x,则
CO(g )+H2O(g)?CO2(g)+H2(g),
起始(mol) 2.0 2.0 0 0
转化(mol) x x x x
平衡(mol) 2-x 2-x x x
平衡常数K=$\frac{x×x}{(2-x)×(2-x)}$=$\frac{8}{3}$,解得x≠1.6,故D错误;
故选C.
点评 本题主要考查平衡常数和转化率的计算,及根据平衡常数对反应作判断,中等难度.要注意温度对平衡常数的影响.

①2C(焦炭)+O2(空气)$\frac{\underline{\;高温\;}}{\;}$2CO②Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是( )
| A. | CO过量 | B. | CO与铁矿石接触不充分 | ||
| C. | 炼铁高炉的高度不够 | D. | CO与Fe2O3的反应有一定限度 |
| A. | 过滤时,漏斗下端要紧贴接液烧杯内壁 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干,然后停止加热 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| A. | 15种 | B. | 6种 | C. | 4种 | D. | 2种 |
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
| A. | 0.10mol•L-1 | B. | 0.15mol•L-1 | C. | 0.225mol•L-1 | D. | 0.30mol•L-1 |
| A. | l mol氯气在足量铁中反应,转移的电子数为3NA | |
| B. | 标准状况下22.4 LH2中含中子数为2 NA | |
| C. | 1 L Imol/L的氯化钠溶液中,所含氯化钠分子数为NA | |
| D. | 常温下46gNO2和N2O4混合气体中含有原子数为3NA |
| A. | 乙烯的结构简式是C2H4 | |
| B. | 氯离子的结构示意图: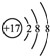 | |
| C. | NaCl的电子式是Na:Cl | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
