题目内容
 根据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图,其中盐桥内装琼脂饱和KNO3溶液.请回答下列问题:
根据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图,其中盐桥内装琼脂饱和KNO3溶液.请回答下列问题:(1)电极X的材料是
(2)银电极为电池的
银电极:
X电极:
(3)外电路中的电子是从
(4)盐桥中向CuSO4溶液中迁移的离子是
A.K+B.NO3- C.Ag+D.SO42-
(5)若导线上转移电子0.5mol,则生成银
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由反应方程式可知,该原电池的电极反应式为:正极:2Ag++2e-═2Ag,负极:Cu-2e-═Cu2+,所以X极的材料应为Cu,电解质溶液Y应为AgNO3溶液,外电路中的电子从Cu极流向Ag极.盐桥中的K+移向正极(Ag极);NO3-移向负极(Cu极),以此解答.
解答:
解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,负极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:正;Ag++e-=Ag;Cu-2e-=Cu2+;
(3)原电池中,电子从负极经外电路流向正极,本题中由Cu极经外电路流向Ag极,故答案为:Cu;Ag;
(4)原电池工作时,阴离子向负极移动,阳离子向正极移动,盐桥中向CuSO4溶液中迁移的离子应是阴离子,应为NO3-,故答案为:B;
(5)若导线上转移电子0.5mol,由电极方程式Ag++e-=Ag可知,生成m9Ag)=0.5mol×108g/mol=54g,故答案为:54.
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,负极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:正;Ag++e-=Ag;Cu-2e-=Cu2+;
(3)原电池中,电子从负极经外电路流向正极,本题中由Cu极经外电路流向Ag极,故答案为:Cu;Ag;
(4)原电池工作时,阴离子向负极移动,阳离子向正极移动,盐桥中向CuSO4溶液中迁移的离子应是阴离子,应为NO3-,故答案为:B;
(5)若导线上转移电子0.5mol,由电极方程式Ag++e-=Ag可知,生成m9Ag)=0.5mol×108g/mol=54g,故答案为:54.
点评:本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法等问题.

练习册系列答案
相关题目
在不同条件下,分别测得反应2SO2+O2?2SO3的化学反应速率,其中表示该反应进行得最快的是( )
| A、ν(SO2)=4mol/(L?min) |
| B、ν(O2)=3 mol/(L?min) |
| C、ν(SO2)=0.1 mol/(L?s) |
| D、ν(SO3)=0.2mol/(L?s) |
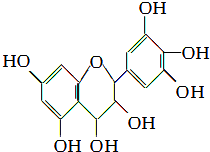 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A、该物质既可看作醇类,也可看作酚类 |
| B、1 mol该物质可与4 mol Br2反应 |
| C、1 mol该物质可与7 mol NaOH反应 |
| D、1 mol该物质可与7 mol Na反应 |
新产品“不粘锅”受到广大群众的欢迎,其生产工艺十分简单:在金属锅的内壁上涂一层聚四氟乙烯.下列说法中正确的是( )
| A、聚四氟乙烯的结构简式是:F2C=CF2 |
| B、聚四氟乙烯中含碳,所以在加热时能够燃烧生成二氧化碳 |
| C、由于C-C键和F-C键很牢固,因而聚四氟乙烯的性质稳定,在使用时不会污染食物 |
| D、聚四氟乙烯中不能与常见的氧化剂接触,防止被氧化 |
 实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如图所示实验,以验证上述混合气体中是否含有乙烯和SO2.
实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如图所示实验,以验证上述混合气体中是否含有乙烯和SO2.