题目内容
14.下列晶体熔化时不需要破坏化学键的是( )| A. | 金刚石 | B. | 氟化镁 | C. | 冰醋酸 | D. | 金属钾 |
分析 发生化学反应时物质中的化学键被破坏,熔化及电离过程中化学键也被破坏,以此来分析.
解答 解:A.金刚石是原子晶体,熔化需要破坏共价键,故A错误;
B.氟化镁属于离子晶体,熔化时破坏离子键,故B错误;
C.冰醋酸属于分子晶体,熔化时破坏分子间作用力,没有破坏化学键,故C正确;
D.金属钾属于金属晶体,熔化时破坏金属键,故D错误.
故选C.
点评 本题考查化学键,熟悉化学反应中、熔化、电离过程中的化学键变化是解答本题的关键,并注意利用分子间作用力不属于化学键来解答.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
19.美国康乃尔大学的魏考克斯(C.Wilxox)所合成的一种有机分子,就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机物分子的说法不正确的是( )

| A. | 该有机物属于苯的同系物 | |
| B. | 1mol该有机物完全燃烧需消耗25molO2 | |
| C. | 该有机物分子中含有21个碳原子 | |
| D. | 该有机物的一氯代物只有6种 |
2.下列关于σ键和π键的理解不正确的是( )
| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | HBr 分子中的σ键是s-p σ键,Cl2分子中的σ键是p-p σ键 | |
| D. | 气体单质中一定存在σ键,可能存在π键 |
9.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | |
| B. | 若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前<N后 |
3.已知:
①H2O(g)═H2O(l)△H=-Q1kJ.mol-1
②C2H5OH(g)═C2H5OH(1)△H=-Q2kJ.mol-1
③C2H5OH(g)═302(g)=2C02(g)+3H20(g)△H=-Q3 kJ.mol-1
下列判断正确的是( )
①H2O(g)═H2O(l)△H=-Q1kJ.mol-1
②C2H5OH(g)═C2H5OH(1)△H=-Q2kJ.mol-1
③C2H5OH(g)═302(g)=2C02(g)+3H20(g)△H=-Q3 kJ.mol-1
下列判断正确的是( )
| A. | 酒精的燃烧热AH=-Q3 kJ•mol-1 | |
| B. | 由③可知1molC2H5OH(g)的能量高于2molC02(g)和3 molH20(g)的总能量 | |
| C. | H20(g)→H20( 1)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液体酒精完全燃烧生成C02(g)和H20( 1),释放热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
4.下列叙述中正确的是( )
| A. | 液态HCl、固体NaCl均不导电,所以HCl和NaCl均是非电解质 | |
| B. | NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质 | |
| C. | 常见的酸、碱和大部分盐都是强电解质 | |
| D. | 强电解质与弱电解质的本质区别,是其在水溶液中的电离程度不同 |
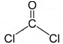 ,分子的立体构型是平面三角形.
,分子的立体构型是平面三角形.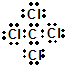 ,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).
,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).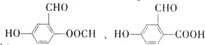 .
.