题目内容
3.已知:①H2O(g)═H2O(l)△H=-Q1kJ.mol-1
②C2H5OH(g)═C2H5OH(1)△H=-Q2kJ.mol-1
③C2H5OH(g)═302(g)=2C02(g)+3H20(g)△H=-Q3 kJ.mol-1
下列判断正确的是( )
| A. | 酒精的燃烧热AH=-Q3 kJ•mol-1 | |
| B. | 由③可知1molC2H5OH(g)的能量高于2molC02(g)和3 molH20(g)的总能量 | |
| C. | H20(g)→H20( 1)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液体酒精完全燃烧生成C02(g)和H20( 1),释放热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、焓变是指反应物的能量和与生成物的能量和之差,不是一部分;
C、放热反应是指化学反应;
D、依据盖斯定律结合热化学方程式计算得到.
解答 解:A、C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应中生成的水是气体,不是稳定氧化物,故燃烧热不是Q3kJ,故A错误;
B、③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应是放热反应,1mol C2H5OH(g)和3molO2的总能量高于2CO2(g)和3H2O(g)的总能量,故B错误;
C、H2O(g)→H2O(l)是物理变化,故C错误;
D、已知:①H2O(g)═H2O(l)△H=-Q1 kJ•mol-1
②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ•mol-1
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ•mol-1
据盖斯定律:③-②+①×3得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-Q3+Q2-3Q1)KJ/mol,23g是0.5molC2H5OH,所以释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ,故D正确;
故选D.
点评 本题考查燃烧热、焓变、放热反应以及盖斯定律的应用,题目难度不大.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
8.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
14.下列晶体熔化时不需要破坏化学键的是( )
| A. | 金刚石 | B. | 氟化镁 | C. | 冰醋酸 | D. | 金属钾 |
11.有7种物质:①乙烷②乙烯③乙炔④苯⑤甲苯⑥溴乙烷⑦聚丙烯,其中既不能使酸性KMnO4溶液褪色,也不能与溴水因发生化学反应而使溴水褪色的是( )
| A. | ①②③⑤ | B. | ①④⑥⑦ | C. | ②④⑥⑦ | D. | ②③④⑤ |
18.下列说法不正确的是( )
| A. | 离子化合物中一定只含离子键 | |
| B. | 共价化合物中一定只含共价键 | |
| C. | 离子化合物中不一定含有金属元素 | |
| D. | 共价键不一定只存在于共价化合物中 |
12.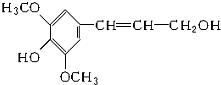 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子中有两种含氧官能团 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 1 mol芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、取代、加成 |
13.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1 mol N5+含有的电子数为34NA | |
| D. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA |
 ,C为HOOC-COOH.A的红外光谱图和核磁共振氢谱图如图1:
,C为HOOC-COOH.A的红外光谱图和核磁共振氢谱图如图1:



 .
.