题目内容
17.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 0.5moL/L的AlCl3溶液中含有氯离子数为1.5NA | |
| B. | 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA | |
| C. | 25℃,1.01×105 Pa,11.2 L Cl2含有的氯原子数为1.0 NA | |
| D. | 1 L 0.1 mol/LNaCl溶液中所含的Na+ 的电子数为1.0NA |
分析 A.溶液的体积不确定;
B.根据n=$\frac{m}{M}$进行求算;
C.只有在标况下Vm为22.4L/mol;
D.先求出溶液中含有的钠离子的物质的量,再根据1molNa+含10mol电子来求算.
解答 解:A.溶液的体积不确定,无法计算,故A错误;
B.64 g SO2的物质的量n=$\frac{m}{M}$=$\frac{64g}{64g/mol}$=1mol,而1molSO2含3mol原子,故含有的原子数为3NA,故B正确;
C.只有在标况下气体摩尔体积Vm才为22.4L/mol,故在常温常压下,11.2 L Cl2的物质的量不是0.5mol,即含有的分子数不是0.5 NA,故C错误;
D.1L0.1mol/L的NaCl溶液中Na+ 的物质的量n=0.1mol,而1molNa+含10mol电子,故0.1molNa+含1mol电子,即NA个,故D正确.
故选BD.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
相关题目
7.已知M(C8Hl602)发生水解反应可生成A、B两种化合物,在一定条件下A可转化为B,则所有A、B反应生成的物质有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
8.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
| 甲 | 乙 | |
| ① | 物质微粒数 | 阿伏加德罗常数 |
| ② | 标况下气体摩尔体积 | 标况下气体体积 |
| ③ | 溶剂的体积 | 溶质的物质的量浓度 |
| ④ | 溶液中溶质的质量分数 | 溶液的质量 |
| ⑤ | 非标况下物质的质量 | 物质的摩尔质量 |
| A. | ③ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
5.用试纸检验气体是一种重要的实验方法.下列试纸的选用以及对应的现象、结论都正确的一项是( )
| A. | 用干燥的pH试纸检验CO2 | |
| B. | 用干燥的红色石蕊试纸检验NH3 | |
| C. | SO2能使湿润的品红试纸褪色 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 |
12.等质量的SO2和SO3 中,下列说法正确的是( )
| A. | 所含氧原子的个数比为2:3 | B. | 所含硫原子的个数比为1:1 | ||
| C. | 所含氧元素的质量比为5:6 | D. | 所含硫元素的质量比为5:4 |
2.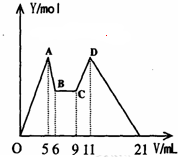 在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )
在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )
 在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )
在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )| A. | 9mL | B. | 7.5mL | C. | 7ml | D. | 6mL |
9.要使NH4Cl溶液中c(NH4+)=c(Cl-),可向其中加入( )
| A. | NH3•H2O | B. | 盐酸 | C. | H2SO4 | D. | CH3COONa |
7.X、Y、Z为短周期主族元素,X的最外层电子数为内层电子数的2倍,Y的最高化合价与最低化合价的代数和为4,Z与Y同周期,Z的原子半径小于Y.下列叙述不正确的是( )
| A. | Z的氢化物是同主族简单氢化物中沸点最低的一种 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y、Z的氢化物中化学键均为极性共价键 |