题目内容
6.在Cl2、Na2S、Na2O2、HClO、H2O2、NH4Cl六种物质中:(1)其中只含非极性键的物质的电子式为
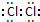 ;
;(2)其中只由极性键构成的物质是HClO(填化学式);
(3)其中由离子键和共价键构成的物质是Na2O2、NH4Cl(填化学式);
(4)H2O2属于共价化合物,其结构式为H-O-O-H;
(5)用电子式表示Na2S的形成过程
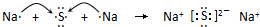 .
.
分析 一般来说,活泼金属与非金属形成离子键,非金属性之间形成共价键,相同的非金属原子之间形成非极性键,不同的非金属原子之间形成极性键,含离子键的一定为离子化合物,只含有共价键的化合物是共价化合物,以此来解答.
解答 解:(1)其中只含非极性键的物质是氯气,其电子式为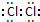 ,故答案为:
,故答案为: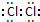 ;
;
(2)其中只由极性键构成的物质是次氯酸,化学式为:HClO,故答案为:HClO;
(3)其中由离子键和共价键构成的物质是过氧化钠中氧氧之间存在非极性键,钠离子与过氧根离子之间是离子键,氯化铵中铵根离子与氯离子之间是离子键,铵根中氮与氢之间是共价键,
故答案为:Na2O2、NH4Cl;
(4)H2O2属于共价化合物,O与H之间存在极性键,氧氧之间存在非极性键,其结构式为H-O-O-H;
故答案为:H-O-O-H;
(5)Na2S是离子化合物,Na失去电子形成钠离子,S得到电子形成硫离子,Na2S的形成过程为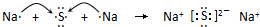 ,
,
故答案为: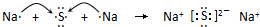 .
.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
16.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:下列说法正确的是( )
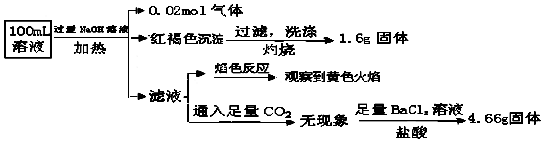

| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
17.用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ②⑤⑥ |
14.有机物X是合成二氢荆芥内酯的重要原料,其结构简式为 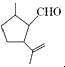 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,加热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,加热,再加入溴水 | |
| D. | 先加入新制氢氧化铜悬浊液,加热,取清液酸化后再加溴水 |
11.NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.5mol C4H10中含有的共价键数为6.5NA | |
| B. | 3.4 g羟基和3.4 g氢氧根均含有2NA个电子 | |
| C. | 1L0.1 mol•L-1CH3COOH溶液中含有的氧原子数为0.2NA | |
| D. | 标准状况下,22.4L由CHCl3和CH2Cl2组成的混合物中含有的分子数目为NA |
18.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA | |
| C. | 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA | |
| D. | 1L0.01mol•L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA |
16.实现下列变化时,需克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和碘的熔化 | ||
| C. | 金刚石和白磷的熔化 | D. | 纯碱和烧碱的熔化 |

 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O.