题目内容
19.下列有关说法中不正确的是( )| A. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{w}}$mol•L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) | |
| B. | 室温下,由水电离出的c(H+)=10-12mol•L-1的溶液的pH可能为2或12 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
分析 A.当c(H+)=c(OH-)时溶液呈中性,结合KW=c(H+)•c(OH-)分析;
B.在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断;
C.析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$,据此进行计算;D.常温下pH=7,则c(H+)=c(OH-),结合电荷守恒判断.
解答 解:A.某温度时的混合溶液中c(H+)=$\sqrt{{K}_{w}}$mol•L-1,而KW=c(H+)•c(OH-),说明c(H+)=c(OH-),则溶液一定为中性,故A正确;
B.25℃时:Kw=c(OH-)×c(H+)=10-14,纯水中c(H+)=c(OH-)=1.0×10-7 mol/L,在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶质可能是酸或碱或强酸的酸式盐,如果为酸溶液,则pH=2,如果为盐溶液,则pH=12,故B正确;
C.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.010}$mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.010}}$mol/L=3×10-5mol/L>1.56×10-8mol/L,所以Cl-先产生沉淀,故C错误;
D.常温下pH=7的CH3COOH和CH3COONa混合溶液呈中性,则c(H+)=c(OH-),结合电荷守恒可知:c(Na+)=c(CH3COO-),故D正确;
故选C.
点评 本题考查较为综合,涉及难溶物溶解平衡及沉淀转化实质、离子浓度大小比较、水的电离及其影响、溶液酸碱性与溶液pH的计算等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,C为易错点,注意掌握计算方法,试题培养了学生的分析能力及灵活应用能力.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | C6H12O6(葡萄糖aq)+6O2$\stackrel{酶}{→}$6CO2+6H2O | |
| B. | CH3COOH+KOH═CH3COOK+H2O | |
| C. | A+B═C+D;△H<0 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
| A. | 稀有气体的化学性质很不活泼 | B. | HF气体比HCl气体沸点高 | ||
| C. | 干冰易升华 | D. | 氮气的化学性质很稳定 |

(1)写出BaCl2的电子式
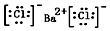 .
.(2)“还原焙烧”时,使过量的无烟煤粉和重晶石粉混合物在高温下发生反应,该反应的化学方程式为BaSO4+4C$\frac{\underline{\;焙烧\;}}{\;}$BaS+4CO↑.
(3)“盐酸浸”得到的是氯化钡粗液,其中残余的含硫化合物会影响产品质量,必须通过鼓入热空气吹除.鼓入热空气能有效去杂的原理是升高温度可降低H2S的溶解度,利于吹出;升高温度,利于使H2S氧化成S沉淀除去.
(4)生产过程中所产生的尾气含有毒性较高的H2S,为防止环境污染,必须进行吸收处理,下列不可行的吸收液是BC.
A.CuSO4溶液B.浓硫酸C.NaHS溶液D.氨水
(5)随着工艺条件的不同,产品BaCl2•xH2O中的x数值有所不同.产品检验部门通常采用的操作是:Ⅰ称取样品a g;Ⅱ充分加热;Ⅲ置于干燥器中冷却;Ⅳ称量质量为b g.由此可得出x=$\frac{208(a-b)}{18b}$(请写出计算表达式).
(6)工业检测MgCl2•xH2O中的x值时不用以上加热法,而多采用沉淀滴定法,其原因是(用化学方程式表示)MgCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl+(x-1)H2O.沉淀滴定的测定步骤为:称取0.5000g待测产品,用适量硝酸溶解,滴加指示剂,用AgNO3标准溶液滴定.
| AgCl | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 黄 | 砖红 |
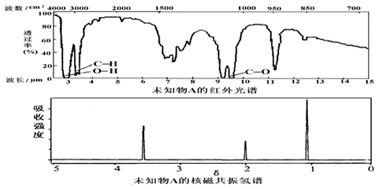
| A. | 由红光外谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 | |
| C. | 若A的化学式为C3H6O,则其结构简式为CH3COCH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |

已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示.
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
| Ksp | 1.0×10-33 | 4.0×10-38 | 2.0×10-20 | 4.0×10-14 |
(1)沉淀1的化学式为CaSO4.
(2)(NH4)2S的电子式为
 ;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.
;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为.
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4.(NH4)2SO4、MnSO4的溶解度曲线如图2所示.
据此判断,操作“I”应为蒸发浓缩、趁热过滤、洗涤、干燥.
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(6)25.35g MnSO4•H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如图3所示.
①300℃时,所得固体的化学式为MnSO4.
②1150℃时,反应的化学方程式为3MnO2$\frac{\underline{\;1150℃\;}}{\;}$Mn3O4+O2↑.
 构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )| A. | 一段时间后电流计指针将归零,此时可视为反应不再进行 | |
| B. | 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升 | |
| C. | 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加 | |
| D. | 实验开始先闭合K2,断开K1,此时NO3-向B电极移动 |
| A. | “可燃冰”被认为是21世纪新型洁净的能源,但大量开发和使用会诱发海底地质灾害,还会加重温室效应 | |
| B. | 碘元素被誉为“智力元素”,KI、KIO3、I2都可作碘盐的添加剂 | |
| C. | 硅橡胶无毒无味、耐高温又耐低温,可制成人造心脏,它属于无机非金属材料 | |
| D. | “雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关 |
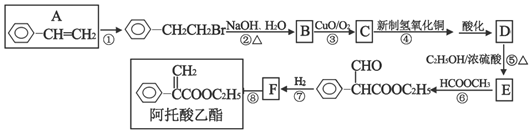
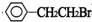 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$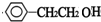 +NaBr.反应③的方程式
+NaBr.反应③的方程式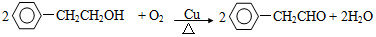 .
.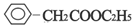 ;
;