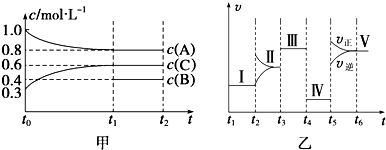
题目内容
18.实验室可用氯气制备无水氯化铁,查阅资料得知:无水氯化铁里棕红色、容易潮解、在100℃左右升华.某课外学习小组设计了如下实验装置制备无水氯化铁,D中硬质玻璃管内的固体为铁粉,E用于收集无水氯化铁.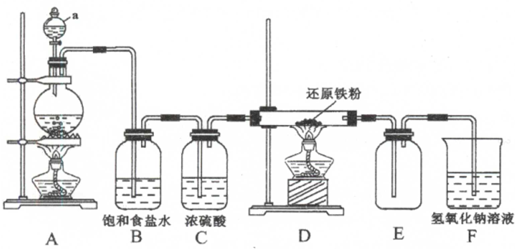
回答下列问题:
(1)仪器a的名称是分液漏斗,F装置的作用是吸收未反应的氯气,防止污染环境.
(2)D中发生反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3,A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)上述实验装置的设计还有不完善的地方,主要有两点,分别是导管易被产品堵塞,不安全产品易受潮而水解,导致产品不纯,
.
分析 根据题中提供的装置可知,该实验是用浓盐酸和二氧化锰加热制取氯气,浓盐酸具有挥发性,所以制取的氯气中含有HCl,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气,然后将纯净、干燥的氯气和Fe加热制取FeCl3,氯气有毒不能直接排空,且氯气能和碱溶液反应,所以用NaOH溶液处理尾气,氯化铁易水解,为防止氢氧化钠溶液中的水份挥发到生成氯化铁的装置中,在产生氯化铁和尾气吸收装置之间要加干燥装置,氯化铁在100℃左右升华,生成的氯化铁在导管中容易冷却成固体,会堵塞导管,据此答题.
解答 解:根据题中提供的装置可知,该实验是用浓盐酸和二氧化锰加热制取氯气,浓盐酸具有挥发性,所以制取的氯气中含有HCl,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气,然后将纯净、干燥的氯气和Fe加热制取FeCl3,氯气有毒不能直接排空,且氯气能和碱溶液反应,所以用NaOH溶液处理尾气,氯化铁易水解,为防止氢氧化钠溶液中的水份挥发到生成氯化铁的装置中,在产生氯化铁和尾气吸收装置之间要加干燥装置,氯化铁在100℃左右升华,生成的氯化铁在导管中容易冷却成固体,会堵塞导管,
(1)根据装置图可知,仪器a的名称是分液漏斗,F装置的作用是吸收未反应的氯气,防止污染环境,
故答案为:分液漏斗;吸收未反应的氯气,防止污染环境;
(2)D中发生反应为铁与氯气反应生成氯化铁,反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3,A中发生的反应是浓盐酸与二氧化锰生成氯气的反应,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)根据上面的分析可知,上述实验装置的设计还有不完善的地方,主要有导管易被产品堵塞,不安全;产品易受潮而水解,导致产品不纯,
故答案为:导管易被产品堵塞,不安全;产品易受潮而水解,导致产品不纯.
点评 本题考查氯气实验室制法、氯化铁的制备等知识点,侧重考查实验操作及盐类水解等知识,为高频考点,知道每个装置的作用及可能发生的反应,难点是实验装置先后顺序排列,题目难度不大.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案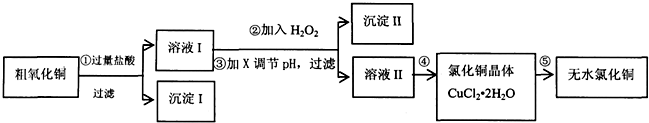
(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的目的:将Fe2+氧化成Fe3+,沉淀Ⅱ的化学式为:Fe(OH)3.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
A.NaOH B.CuO C.Cu(OH)2 D.NH3•H2O
(4)步骤④的操作是蒸发浓缩、冷却结晶,过滤、洗涤、干燥.为得到无水CuCl2,步骤⑤需在干燥的HCl气流中加热CuCl2•2H2O,原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
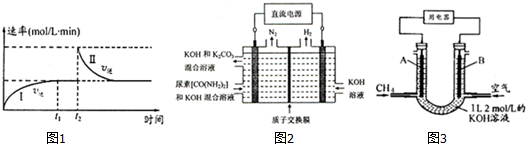
a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 V=44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.