题目内容
7.(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图1.下列说法正确的是ac(填序号字母)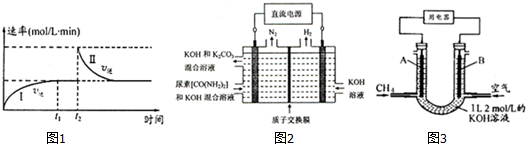
a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 V=44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.
分析 (1)a.0~t1时,逆反应速率增大,反应向正反应进行,t2时改变条件,逆反应速率减小,反应向逆反应进行;
b.混合气体的密度始终不变;
c.t2时刻若向密闭容器中加C,平衡逆向移动,反应前后气体的体积不变,恒温恒容下平衡时物质的浓度与原平衡相同;
d.平衡常数只受温度影响,若是升高温度使平衡逆向移动,平衡时的反应速率应高于原平衡;
(2)①根据v=$\frac{\frac{△n}{V}}{△t}$计算υ (CO2 );
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,与起始投入的二氧化碳与氨气的物质的量之比均为1:4,等效为在原平衡的基础上增大压强,平衡正向移动;
③平衡时二氧化碳为0.02mol,计算平衡时各组分的物质的量浓度,代入平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$计算;
④电解尿素〔CO(NH2)2〕的碱性溶液制取氢气,由图可知,阳极上是尿素失去电子,碱性条件下生成氮气、碳酸根离子,还有水生成;
(3)V(甲烷)=44.8L,则n(甲烷)=2mol,而KOH为1L×2mol/L=2mol,二者物质的量之比为1:1,故反应生成碳酸氢钾与水.
解答 解:(1)a.0~t1时,逆反应速率增大,反应向正反应进行,则v正>v逆,t2时改变条件,逆反应速率减小,反应向逆反应进行,t2时,v逆>v正,故a正确;
b.混合气体总质量不变,反应前后气体的物质的量不变,恒温条件下,容器的容积不变,混合气体的密度始终不变,故b错误;
c.t2时刻若向密闭容器中加C,平衡逆向移动,反应前后气体的体积不变,恒温恒容下平衡时物质的浓度与原平衡相同,反应速率相同,故c正确;
d.平衡常数只受温度影响,若是升高温度使平衡逆向移动,平衡时的反应速率应高于原平衡,而图象为速率相等,故d错误,
故选:ac;
(2)①υ (CO2 )=$\frac{\frac{0.1mol-0.02mol}{2L}}{70min}$=0.00057mol/(L.min),故答案为:0.00057;
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,与起始投入的二氧化碳与氨气的物质的量之比均为1:4,等效为在原平衡的基础上增大压强,平衡正向移动,二氧化碳的转化率增大,故答案为:增大;
③平衡时二氧化碳为0.02mol,则:
CO2(g)+2NH3(g)?CO(NH2)2(1)+H2O(g)
开始(mol):0.1 0.4 0
转化(mol):0.08 0.16 0.08
平衡(mol):0.02 0.24 0.08
平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$=$\frac{\frac{0.08}{2}}{\frac{0.02}{2}×(\frac{0.24}{2})^{2}}$=277.8,
故答案为:277.8;
④电解尿素〔CO(NH2)2〕的碱性溶液制取氢气,由图可知,阳极上是尿素失去电子,碱性条件下生成氮气、碳酸根离子,还有水生成,阳极电极反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(3)V(甲烷)=44.8L,则n(甲烷)=2mol,而KOH为1L×2mol/L=2mol,二者物质的量之比为1:1,故反应生成碳酸氢钾与水,电池总反应方程式为:CH4+2O2+KOH=KHCO3+2H2O,
故答案为:CH4+2O2+KOH=KHCO3+2H2O.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、电化学等,(1)为易错点,学生容易忽略平衡时的速率相等,难度中等.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)主要试剂及其物理性质
| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |
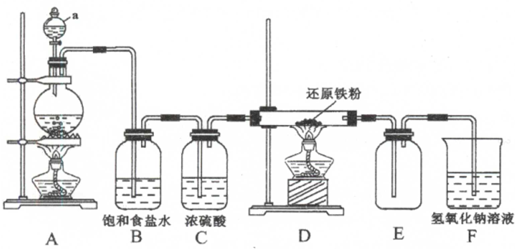
主要实验步骤和装置如下:

Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾.在140~170℃,将此混合物回流45min.
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物.回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥.实验中为控制温度在140~170℃需在BD中加热(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在通风橱或通风处中进行操作.
(2)图2中水蒸气蒸馏后产品在三颈烧瓶(填仪器名称)
(3)趁热过滤的目的防止肉桂酸钠结晶而析出堵塞漏斗,方法:用热过滤漏斗或采取保温措施.
(4)加入1:1的盐酸的目的是使肉桂酸盐转化为肉桂酸,析出的肉桂酸晶体通过减压过滤与母液分离.下列说法正确的是ACD.
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是41.9%(保留3位有效数字).

(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.该用品能否用铁质用品代替不能,原因是①铁的导热系数大,容易散热;②铁会与盐酸反应
(2)图示中用品填加后的装置叫量热器.
(3)烧杯间填满碎纸条的作用是保温,减少热量的散失.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”).
(5)如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”).已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,写出上述反应的热化学方程式NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值偏低(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |

 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题: