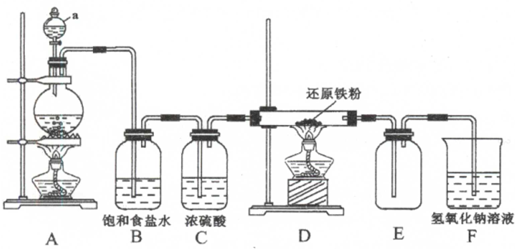
题目内容
13.某同学拟用粗氧化铜(含少量FeO及不溶于酸的杂质)制取无水氯化铜,流程如图所示: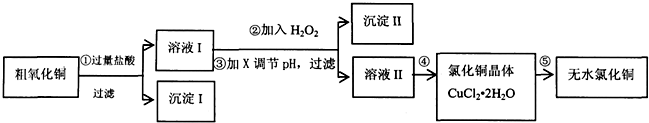
(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的目的:将Fe2+氧化成Fe3+,沉淀Ⅱ的化学式为:Fe(OH)3.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
A.NaOH B.CuO C.Cu(OH)2 D.NH3•H2O
(4)步骤④的操作是蒸发浓缩、冷却结晶,过滤、洗涤、干燥.为得到无水CuCl2,步骤⑤需在干燥的HCl气流中加热CuCl2•2H2O,原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
分析 向粗氧化铜(含少量FeO及不溶于酸的杂质)中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,
(1)氧化铜和盐酸反应生成氯化铜和水;
(2)操作②是加入氧化剂把亚铁离子氧化为铁离子;步骤③是加入氧化铜或Cu(OH)2调节溶液pH使铁离子完全沉淀;
(3)通过调节pH可以使Fe3+沉淀完全但不能引入新的杂质;
(4)从溶液中要获得晶体应经过蒸发浓缩、冷却结晶、过滤、洗涤;
(5)氯化氢抑制氯化铜的水解,以便得到氯化铜晶体.
解答 解:向粗氧化铜(含少量FeO及不溶于酸的杂质)中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,
(1)步骤①中氧化铜与盐酸反应氧化铜和盐酸反应生成氯化铜和水,反应的离子方程式是:CuO+2H+=Cu2++H2O,
故答案为:CuO+2H+=Cu2++H2O;
(2)操作②是加入氧化剂把亚铁离子氧化为铁离子但不能引入新的杂质,氧化剂选择过氧化氢氧化亚铁离子的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
步骤③是加入氧化铜调节溶液pH到大于3.2,小于4.7,使铁离子完全沉淀,
故答案为:将Fe2+氧化成Fe3+;Fe(OH)3;
(3)溶液C通过调节pH可以使Fe3+沉淀完全,应加入CuO或Cu(OH)2,而加入氢氧化钠引入Na+,加入氨水引入新的杂质NH4+,
故答案为:BC;
(4)从溶液中获得晶体要经过蒸发浓缩、冷却结晶、过滤、洗涤一系列步骤;
步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,是为了抑制铜离子的水解得到氯化铜晶体同时带走产生的水蒸气,
故答案为:蒸发浓缩、冷却结晶;干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
点评 本题考查了物质制备实验设计、物质分离的实验基本操作,物质性质的理解和掌握是解题关键,题目难度中等.

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| A. | 硬脂酸与软脂酸(C15H31COOH) | B. | HCHO与CH3COOH | ||
| C. | CH2=CHCOOH与CH3CH2CH2COOH | D. |  |
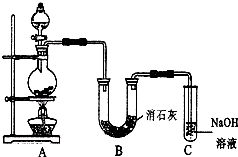 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).