题目内容
以下物质不能通过化合反应实现的是( )
| A、NaHCO3 |
| B、Fe(OH)3 |
| C、Cu(OH)2 |
| D、FeCl2 |
考点:钠的重要化合物,铁的氧化物和氢氧化物,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:A.可由碳酸钠、二氧化碳和水反应生成;
B.可由氢氧化亚铁、氧气和水反应生成;
C.不能通过化合反应生成;
D.可由氯化铁和铁反应生成.
B.可由氢氧化亚铁、氧气和水反应生成;
C.不能通过化合反应生成;
D.可由氯化铁和铁反应生成.
解答:
解:A.可由碳酸钠、二氧化碳和水反应生成,方程式为Na2CO3+CO2+H2O=2NaHCO3,故A正确;
B.氢氧化亚铁与水和氧气反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故B正确;
C.不能通过化合反应生成,可用氯化铜与氢氧化钠发生复分解反应制取,故C错误;
D.Fe和FeCl3反应生成FeCl2,方程式为:Fe+2FeCl3=3FeCl2,故D正确.
故选C.
B.氢氧化亚铁与水和氧气反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故B正确;
C.不能通过化合反应生成,可用氯化铜与氢氧化钠发生复分解反应制取,故C错误;
D.Fe和FeCl3反应生成FeCl2,方程式为:Fe+2FeCl3=3FeCl2,故D正确.
故选C.
点评:本题综合考查元素化合物知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意常见物质的性质以及反应类型的判断,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
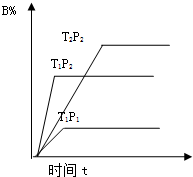 已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分
已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分数(B%)的关系曲线.由曲线分析下列判断正确的是( )
| A、T1<T2 P1>P2m+n>p 正反应为吸热反应 |
| B、T1>T2 P2>P1 m+n<p 正反应为吸热反应 |
| C、T2>T1 P2>P1m+n<p 正反应为吸热反应 |
| D、T1>T2 P2>P1 m+n<p 正反应为放热反应 |
加热纯碱和小苏打的混合物20克,至质量不再变化为止,冷却后称量其固体质量是13.8克,则原混合物中纯碱的质量分数是( )
| A、84% | B、8.4% |
| C、1.6% | D、16% |
下列物质性质与应用对应关系正确的是( )
| A、漂白粉在空气中不稳定,可用于漂白纸张 |
| B、医用酒精能使蛋白质变性,可用于消毒杀菌 |
| C、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| D、铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀 |
一定条件下,在体积固定的密闭容器中通入2.0mol SO2、1.2mol O2,发生反应2SO2(g)+O2(g)═
2SO3(g)△H=-198kJ?mol -1,下列判断不正确的是( )
2SO3(g)△H=-198kJ?mol -1,下列判断不正确的是( )
| A、2SO2(g)+O2(g)═2SO3(s)△H<-198kJ?mol-1 |
| B、增加反应物的量不能改变上述反应的△H |
| C、充分反应后,放出的热量小于198 kJ |
| D、若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60% |
实验室需配制一种只含有四种离子(除H+和OH-外)的混合溶液,且在该混合溶液中四种离子的物质的量浓度均为0.1mol/L,以下各组能达到此目的是( )
| A、K+、SO42-、I-、NO3- |
| B、Cu2+、Na+、Cl-、S2- |
| C、Na+、K+、HCO3-、NO3- |
| D、K+、Ba2+、CH3COO-、Br- |
