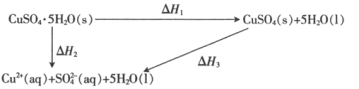
题目内容
【题目】某化学兴趣小组用如下实验探究SO2的性质。回答下列问题:
(l)甲同学用废铜屑与浓硫酸为原料制取SO2,发生反应的化学方程式为 ________;SO2是____氧化物,故产生的SO2尾气可用 ____填化学式)溶液吸收。
(2)乙同学向盛有2 mL氯水的试管中通人SO2 一段时间后溶液褪色。SO2 表现出的性质是____,发生反应的离子方程式为____。
(3)丙同学的实验装置如图所示,装置A中SO2和O2的流速比约为____;加热后,玻璃管中的反应方程式为____。

【答案】2H2SO4(浓)+Cu![]() CuSO4+2H2O +SO2↑ 酸性 NaOH(或其它合理答案) 还原性
CuSO4+2H2O +SO2↑ 酸性 NaOH(或其它合理答案) 还原性 ![]() 2:1 2SO2 + O2
2:1 2SO2 + O2![]() 2SO3
2SO3
【解析】
实验室可用浓硫酸与铜共热制SO2;SO2中的S为+4价,不是最高价,有较强的还原性,能被Cl2和O2等氧化性强的物质氧化;SO2是酸性氧化物,能用碱吸收。
(l)铜与浓硫酸加热时能发生反应生成SO2,化学方程式为:2H2SO4(浓)+Cu![]() CuSO4+2H2O +SO2↑;SO2能和碱反应生成盐和水,属于酸性氧化物,故产生的SO2尾气可用NaOH等碱性溶液吸收。答案为:2H2SO4(浓)+Cu
CuSO4+2H2O +SO2↑;SO2能和碱反应生成盐和水,属于酸性氧化物,故产生的SO2尾气可用NaOH等碱性溶液吸收。答案为:2H2SO4(浓)+Cu![]() CuSO4+2H2O +SO2↑;酸性;NaOH(或其它合理答案)
CuSO4+2H2O +SO2↑;酸性;NaOH(或其它合理答案)
(2)SO2使氯水褪色,是因为SO2有较强的还原性,被Cl2氧化成H2SO4,而Cl2被还原成HCl,反应的离子方程式为:![]() 。答案为:还原性;
。答案为:还原性; ![]()
(3)SO2和O2反应生成SO3,需要的条件是:催化剂、加热,是可逆反应,所以方程式为2SO2+ O2![]() 2SO3,根据方程式可知,SO2和O2按2:1反应,所以应控制装置A中SO2和O2的流速比约为2:1。答案为:2:1;2SO2+ O2
2SO3,根据方程式可知,SO2和O2按2:1反应,所以应控制装置A中SO2和O2的流速比约为2:1。答案为:2:1;2SO2+ O2![]() 2SO3
2SO3