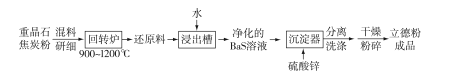
题目内容
【题目】在恒容密闭容器中进行反应:X2(g)+Y2(g)![]() Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1,0.3mol·L-1,0.2mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1,0.3mol·L-1,0.2mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
A.Z为0.3mol·L-1B.X2为0.3mol·L-1
C.Y2为0.4mol·L-1D.Z为0.4mol·L-1
【答案】C
【解析】
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(g)+Y2(g)![]() Z(g)
Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0 0.2 0.3
若反应逆反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(g)+Y2(g)![]() Z(g)
Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.2 0.2 0.2
平衡(mol/L):0.3 0.5 0
由于为可逆反应,物质不能完全转化,所以平衡时浓度范围为0<c(X2)<0.3,0.2<c(Y2)<0.5,0<c(Z)<0.3,选项中,只有C不在范围内。
答案选C。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
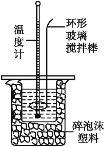
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:__________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算结果为____kJmol-1,与57.3 kJmol-1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】滴定法是化学上常用的定量分析的方法,滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
Ⅰ.甲化学兴趣小组取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.200 0 mol·L-1的标准NaOH溶液进行滴定,重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察________。(填标号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是_________________。
(3)根据表中数据,计算待测盐酸溶液的浓度为________ mol·L-1。
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01 mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,试回答下列问题:
(4)步骤①发生的化学反应方程式为__________;加入的指示剂是____________。
(5)步骤②应使用________式滴定管。
(6)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是________。(填标号)
A.配制标准Na2S2O3溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准Na2S2O3溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.滴定前尖嘴部分有气泡,滴定后消失