题目内容
6.在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O 中(1)用单线桥标出电子转移
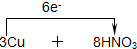 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O(2)还原剂是Cu,被还原的元素是N,还原产物是NO.
(3)若生成2mol的NO气体,溶液中生成的Cu2+为3mol.
(4)在反应中硝酸显示酸性和氧化性.
分析 3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,该反应中转移电子为6e-,以此来解答.
解答 解:(1)该反应中铜元素的化合价变化为0价→+2价,氮元素的化合价变化为+5价→+4价,所以得失电子的最小公倍数是2,所以其电子转移的方向和数目为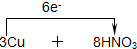 =3Cu(NO3)2+2NO↑+4H2O,
=3Cu(NO3)2+2NO↑+4H2O,
故答案为: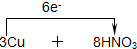 =3Cu(NO3)2+2NO↑+4H2O;
=3Cu(NO3)2+2NO↑+4H2O;
(2)铜元素的化合价升高,Cu是还原剂,氮元素的化合价降低,硝酸被还原,NO为还原产物;
故答案为:Cu;N;NO;
(3)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,若生成2mol的NO气体,溶液中生成的Cu2+为3mol;
故答案为:3;
(4)N元素的化合价降低,则HNO3为氧化剂,硝酸表现氧化性,反应生成硝酸铜,硝酸表现酸性;
故答案为:酸;氧化.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化为解答的关键,侧重电子转移方向和数目的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.一些治感冒的药物含有PPA成分,PPA对感冒有比较好的对症疗效,但也有较大的副作用,2000年11月,我国药监局紧急通知,停止使用含有PPA成分的感冒药,PPA是盐酸苯丙醇胺,从其名称看,其有机成份的分子结构中肯定不含下列中的( )
| A. | -OH | B. | -COOH | C. | -C 6H 5 | D. | -NH 2 |
14.下列关于有机物的说法错误的是( )
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 30℃甲苯与浓硫酸浓硝酸混合,反应的主要产物为邻硝基甲苯和对硝基甲苯 | |
| C. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
1.下列操作错误的是( )
①给烧瓶加热必须使用石棉网
②制取蒸馏水的装置温度计要插入加热的水中
③分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗上的小孔
④振荡分液漏斗中的溶液时,要一只手按住口部,另一只手握住活塞部分颠倒振荡
⑤容量瓶的刻度线上方有水珠未干燥就开始配制溶液
⑥实验室制取氯气时,为了防止环境污染,多余的氯气可以用稀氢氧化钙溶液吸收.
①给烧瓶加热必须使用石棉网
②制取蒸馏水的装置温度计要插入加热的水中
③分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗上的小孔
④振荡分液漏斗中的溶液时,要一只手按住口部,另一只手握住活塞部分颠倒振荡
⑤容量瓶的刻度线上方有水珠未干燥就开始配制溶液
⑥实验室制取氯气时,为了防止环境污染,多余的氯气可以用稀氢氧化钙溶液吸收.
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ③⑤⑥ |
11. 2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )
2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )
 2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )
2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )| A. | CO与CO2均为酸性氧化物 | |
| B. | 大量CO2的排放可导致酸雨的形成 | |
| C. | CO与O形成化学键过程中有电子转移 | |
| D. | 固体催化剂的使用会降低该反应的焓变 |
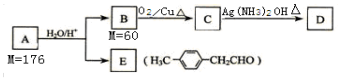
18.某有机物X的结构筒式如图所示,下列有关说法错误的是( )
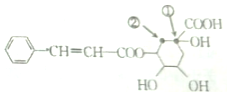

| A. | X分子中含有三种含氧官能团 | |
| B. | 若X中加入溴的四氯化碳溶液或酸性高锰酸钾溶液均褪色,则证明X分子中一定含有碳碳双键 | |
| C. | X能发生加成反应、取代反应、氧化反应和加聚反应 | |
| D. | 将①处碳原子上的-OH转移到②处碳原子上得到的有机物与X互为同分异构体 |