题目内容
6.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,
与上述实验相比,所放出的热量偏高(填“相等、偏高、偏低”),所求中和热不变(填“相等、偏高、偏低”)
(3)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).原因一水合氨电离要吸热.
分析 (1)中和热测定实验成败的关键是保温工作;
(2)反应放出的热量和所用酸以及碱的量的多少有关,根据中和热的概念和实质来回答;
(3)弱电解质电离吸热.
解答 解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(2)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的物质的量增多,所放出的热量偏高,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,中和热数值相等;
故答案为:偏高;不变;
(3)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,中和热的数值会偏小;
故答案为:偏小;一水合氨电离要吸热.
点评 本题考查学生有关中和热的装置和误差分析,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
14.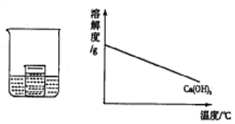 如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
 如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )| 序号 | 试剂X | 试剂Y | 小烧杯中的现象 |
| A | 水 | 硝酸铵 | 产生白色沉淀 |
| B | 水 | 浓硫酸 | 无明显变化 |
| C | 盐酸 | 镁条 | 产生白色沉淀 |
| D | 硫酸 | 氢氧化钠 | 无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
11.甲溶液的pH为4,乙溶液的pH为2,甲溶液与乙溶液的c(H+)之比为( )
| A. | 100 | B. | $\frac{1}{100}$ | C. | 2 | D. | $\frac{1}{2}$ |
18.已知NaCl、Na2SO4、Na3PO4三种溶质的物质的量浓度之比是1:1:2,三种溶液的体积比为2:2:1,则这三种溶液中Na+个数比是( )
| A. | 1:3:6 | B. | 2:3:9 | C. | 9:3:1 | D. | 1:2:3 |
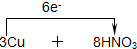 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O
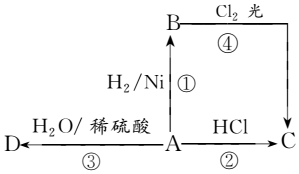 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: